题目内容
11.常温下,已知有某浓度的CH3COOH溶液,下列说法不正确的是( )| A. | 该溶液与等浓度NaOH溶液等体积混合后,pH>7 | |
| B. | 测得Na2CO3的碱性比CH3COONa溶液强,因此得出醋酸的酸性比碳酸强的结论 | |
| C. | 若向该溶液中加入少量CH3COONa固体,恢复至常温后,c(CH3COOH)比原来增大 | |
| D. | 若向一定浓度的CH3COONa溶液中加入少量CH3COONa固体,恢复至常温后,其水解程度比原来下降 |
分析 A、醋酸钠溶液显碱性;
B、弱酸的酸性越弱,其酸根的水解程度越大;
C、向醋酸溶液中加入醋酸钠,醋酸根离子浓度增大,醋酸的电离平衡逆向移动;
D、若为醋酸钠饱和溶液,再加入醋酸钠,醋酸钠浓度不变.
解答 解:A、醋酸与NaOH中和生成醋酸钠,醋酸钠溶液显碱性,pH>7,故A正确;
B、碳酸钠溶液碱性比醋酸钠强,说明碳酸根离子水解程度大于醋酸根,醋酸酸性强,故B正确;
C、醋酸根离子浓度增大,抑制醋酸电离,醋酸分子浓度增大,故C正确;
D、向饱和醋酸钠溶液中再加入醋酸钠,醋酸钠不再溶解,醋酸根离子浓度不变,水解程度不变,故D错误;
故选D.
点评 本题考查了盐类水解影响因素、弱酸的电离平衡移动的影响因素以及饱和溶液的相关知识,难度不大.

练习册系列答案
相关题目
1.某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几钟.将X通过适量的氯水时,X完全被吸收.将所得的无色溶液分装于两支试管后,分别加入酸化AgNO3与BaCl2溶液,结果均产生白色沉淀.下列推论正确的是( )
| A. | X中可能有HBr | B. | X中一定有SO2 | C. | X中可能有CO2 | D. | X中一定有HCl |
2.由下列结构片段组成的蛋白质在胃液中水解,不可能产生的氨基酸是( )
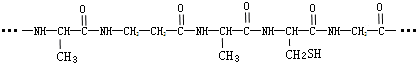

| A. | 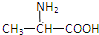 | B. | H2NCH2COOH | C. | 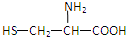 | D. | 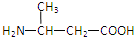 |
19.有五种元素X、Y、Z、Q、T、X元素为主族元素,X原子的M层上有两个未成对电子且无空轨迹;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p亚层上有一个空轨道;Q原子的L电子层的p亚层上有一对成对电子;T原子的M电子层上p轨道半充满.下列叙述不正确的是( )
| A. | 元素Y和Q可形成一种化合物Y2Q3 | |
| B. | T有一种单质的空间型为正四面体形 | |
| C. | X和Q结合生成的化合物为离子化合物 | |
| D. | ZO2是极性键构成的非极性分子 |
3.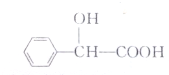 某有机物的结构如下所示,有关该物质的说法错误的是( )
某有机物的结构如下所示,有关该物质的说法错误的是( )
 某有机物的结构如下所示,有关该物质的说法错误的是( )
某有机物的结构如下所示,有关该物质的说法错误的是( )| A. | 该物质的分子式为C8H8O3 | |
| B. | 该物质分子中的8个碳原子都在同一个平面上 | |
| C. | 该物质既可以发生酯化反应又可以发生缩聚反应 | |
| D. | 1mol该物质可以与2mol金属Na反应 |
14.乙酸香兰酯是用于调配奶油、冰淇淋的食用香精,其合成反应的化学方程式如下:下列叙述正确的是( )
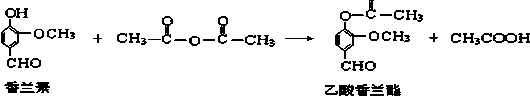
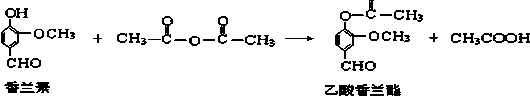
| A. | 该反应属于加成反应 | |
| B. | FeCl3溶液可用于区别香兰素与乙酸香兰酯 | |
| C. | 乙酸香兰酯的分子式为C10H8O4 | |
| D. | 乙酸香兰酯在足量NaOH溶液中水解得到乙酸和香兰素 |

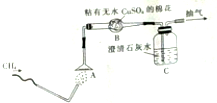 为了验证甲烷的燃烧产物,某同学设计了甲烷的燃烧实验(如图所示):
为了验证甲烷的燃烧产物,某同学设计了甲烷的燃烧实验(如图所示):