题目内容
7.下列叙述中,正确的是( )| A. | 1 mol 乙烯分子中含有的σ 键数目为5NA | |
| B. | 1 mol甲基(-CH3)中含有电子的数目为10NA | |
| C. | 标准状况下,1L戊烷在空气中完全燃烧生成$\frac{5}{22.4}$L的CO2 | |
| D. | 14 g乙烯和丙烯的混合物中含有的氢原子总数为3NA |
分析 A.乙烯结构简式为CH2=CH2,1个乙烯分子含有5个σ 键,再根据N=nNA计算σ 键数目;
B.每个甲基含有9个电子,电子物质的量为甲基的9倍,再根据N=nNA计算电子数目;
C.标况下,戊烷为液态;
D.乙烯、丙烯的最简式均为CH2,根据n=$\frac{m}{M}$计算最简式的物质的量,进而计算H原子物质的量,再根据N=nNA计算氢原子数目.
解答 解:A.乙烯结构简式为CH2=CH2,1个乙烯分子含有5个σ 键,1 mol 乙烯分子中含有的σ 键数目为5NA,故A正确;
B.每个甲基含有9个电子,1mol甲基含有电子物质的量为9mol,含有电子的数目为9NA,故B错误;
C.标况下,戊烷为液态,不能利用气体摩尔体积计算戊烷的物质的量,故C错误;
D.乙烯、丙烯的最简式均为CH2,最简式的物质的量为$\frac{14g}{14g/mol}$=1mol,H原子物质的量为2mol,则混合气体含有氢原子数目为2NA,故D错误,
故选A.
点评 本题考查物质的量有关计算,比较基础,C选项为易错点,注意气体摩尔体积的使用条件与对象.

练习册系列答案
相关题目
17.11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68LCO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为( )
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
18.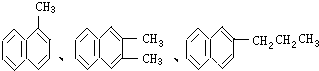 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )
 都属于萘的同系物.萘和萘的同系物分子组成通式是( )
都属于萘的同系物.萘和萘的同系物分子组成通式是( )| A. | CnH2n-6(n≥11) | B. | CnH2n-8(n>10) | C. | CnH2n-10(n≥10) | D. | CnH2n-12(n≥10) |
15.与氨碱法比较,下列关于联合制碱法优点的判断中不正确的是( )
| A. | 提高了原料利用率 | B. | 降低了生产成本 | ||
| C. | 减少了环境污染 | D. | 减轻了对设备的腐蚀 |
2.由下列结构片段组成的蛋白质在胃液中水解,不可能产生的氨基酸是( )
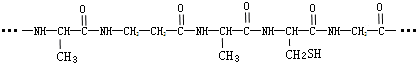

| A. | 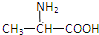 | B. | H2NCH2COOH | C. | 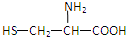 | D. | 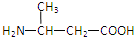 |
19.有五种元素X、Y、Z、Q、T、X元素为主族元素,X原子的M层上有两个未成对电子且无空轨迹;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p亚层上有一个空轨道;Q原子的L电子层的p亚层上有一对成对电子;T原子的M电子层上p轨道半充满.下列叙述不正确的是( )
| A. | 元素Y和Q可形成一种化合物Y2Q3 | |
| B. | T有一种单质的空间型为正四面体形 | |
| C. | X和Q结合生成的化合物为离子化合物 | |
| D. | ZO2是极性键构成的非极性分子 |
 ,1个O22+中含有2个π键.
,1个O22+中含有2个π键.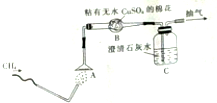 为了验证甲烷的燃烧产物,某同学设计了甲烷的燃烧实验(如图所示):
为了验证甲烷的燃烧产物,某同学设计了甲烷的燃烧实验(如图所示):
 ;
;