题目内容
8.Ca(OH)2溶解度随温度变化画线如图所示,下列说法正确的是( )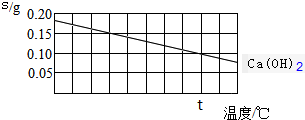
| A. | 氢氧化钙的溶解是吸热过程 | |
| B. | 温度升高时氢氧化钙溶解的速度减慢 | |
| C. | t℃时氢氧化钙的Ksp约等于2.46×10-4 | |
| D. | 向含有Ca(OH)2和Mg(OH)2两种沉淀的悬浊液中滴加NaOH浓溶液,分散系中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$的比值不变 |
分析 A、依据此溶解度图可以得出,温度越高,氢氧化钙的溶解度越低;
B、升高温度,溶解速率与结晶速率均加快;
C、依据k=c(Ca2+)×c2(OH-)计算即可;
D、依据各自的溶度积常数计算即可.
解答 解:A、依据此溶解度图可以得出,温度越高,氢氧化钙的溶解度越低,不能说明氢氧化钙溶于水为吸热反应,氢氧化钙溶于水,为放热,故A错误;
B、升高温度,溶解速率与结晶速率均加快,故B错误;
C、t℃时氢氧化钙的溶解度为0.1g,故生成钙离子的物质的量为:$\frac{0.1g}{74g/mol}$≈0.00135mol,故浓度为:$\frac{0.00135mol}{0.1L}$=0.0135mol/L,k=c(Ca2+)×c2(OH-)=0.0135×(0.0135×2)2=9.8×10-6,故C错误;
D、Ksp[Ca(OH)2]=c(Ca2+)×c2(OH-),Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-),温度不变,Ksp不变,在同一溶液中,由于c(OH-)相同,故$\frac{Ksp[Ca(OH)_{2}]}{Ksp[Mg(OH)_{2}]}$=$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$,此值不变,故D正确,故选D.
点评 本题主要考查的是常见物质的溶解度曲线与溶度积常数的有关计算,难度较大,需认真分析.

练习册系列答案
相关题目
18.电子层数相同的三种元素X、Y、Z,已知其最高价氧化物对应水化物的酸性强弱为HXO4>H2YO4>H3ZO4.下列判断错误的是( )
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 原子半径:X>Y>Z | ||
| C. | 非金属性:X>Y>Z | D. | 单质氧化性:X>Y>Z |
19.以下有机物:
(1)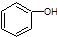 (2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH
(2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH
请将它所对应的物质类别填入下列表格中并写出官能团名称
(1)
 (2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH
(2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH请将它所对应的物质类别填入下列表格中并写出官能团名称
| 物质序号 | 物质类别 | 官能团名称 | 物质序号 | 物质类别 | 官能团名称 |
| (1) | (4) | ||||
| (2) | (5) | ||||
| (3) | (6) |
16.每种物质都既有离子键,又有共价键的一组物质是( )
| A. | NaOH、H2SO4、(NH4)2SO4 | B. | MgO、Na2SO4、NH4HCO3 | ||
| C. | Na2O2、NH4Cl、Na2SO4 | D. | HCl、Al2O3、MgCl2 |
17.某有机物除含碳氢元素外,可能含有氧元素.取该物质a g在足量O2 中充分燃烧后,在120℃下将产物全部通过足量的过氧化钠,充分反应后,过氧化钠固体质量也增加ag.则下列说法正确的是( )
| A. | 该物质中不一定含有氧元素 | |
| B. | 该物质的分子组成必须满足n(C)=n(H) | |
| C. | 该物质中一定含有氧元素,且必须满足n(C)=n(O) | |
| D. | 该物质一定不溶于水 |
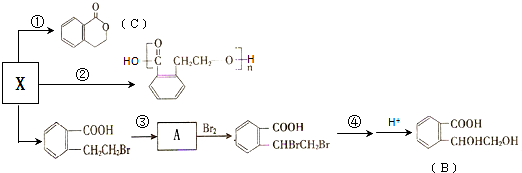
18.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得(已知在中学阶段羧基、酯基、酰胺基(-CONH-)不与氢气发生加成反应,给特殊信息除外,下同):
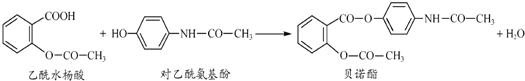
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 1mol贝诺酯分子可与6molH2完全反应 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| D. | 乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
 在酸性条件下水解生成M和N:
在酸性条件下水解生成M和N: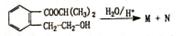
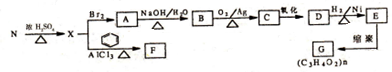
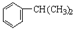 .
.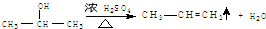 ,E转化为G的化学方程式为
,E转化为G的化学方程式为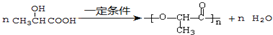 .
.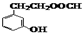 .
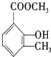
.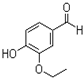 乙基香兰素是一种合成香料,其结构简式如图:
乙基香兰素是一种合成香料,其结构简式如图: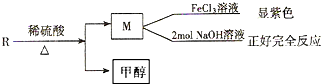
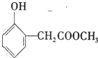 、
、 ;
;
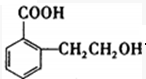 ;B中含氧官能团的名称羟基、羧基;
;B中含氧官能团的名称羟基、羧基; .
.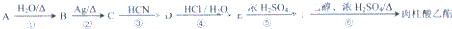
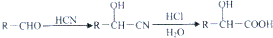
 ,肉酸乙酯的结构简式
,肉酸乙酯的结构简式 .
. .
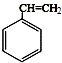
.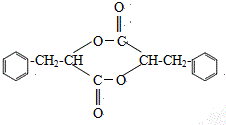 ;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.
;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.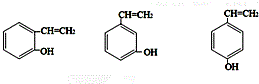 (填结构简式).
(填结构简式).