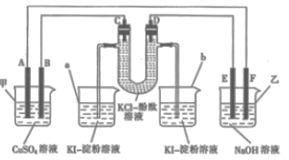
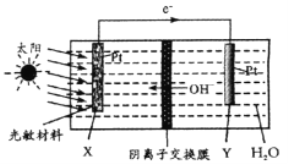
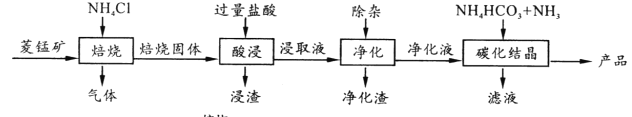
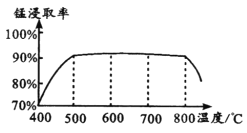
题目内容
【题目】A、B、C、D、E为前四周期元素,且原子序数依次增大
A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
B | 地壳中含量最多的元素,2P轨道上有二个孤电子 |
C | 与B同主族 |
D | 前四周期中金属性最强的元素 |
E | 前四周期中原子核外孤电子数最多 |
(1)C元素位于第__________________周期__________________族,B元素的核外电子排布式为__________________,E元素的价电子排布图为__________________。
(2)B、C两元素的电负性大小关系为:__________________(用元素符号表示),A、B的最简单气态氢化物的稳定性强弱大小关系为:________________(用氢化物的化学式表示)。
(3)B的氢化物由固体变为气态所需克服的微粒间的作用有__________________。
(4)有A、B、C三种元素及氢元素组成的既含离子键又含共价键且其中元素C显最高价的酸式盐的化学式是__________________。
(5)D2B2的电子式为__________________,与CO2反应生成B的单质的化学方程式为:__________________。
(6)E2O72-具有强氧化性,可与含有C元素的某种还原性离子反应(该离子中C元素显+4价),在酸性条件下该反应的离子方程式为:__________________
【答案】 三(或3) VIA 1s22s22p4 ![]() O>S(或S<O) NH3<H2O (或H2O>NH3) 范德华力、氢键 NH4HSO4
O>S(或S<O) NH3<H2O (或H2O>NH3) 范德华力、氢键 NH4HSO4 ![]() 2K2O2+2CO2=2K2CO3+O2 Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O(3分) (表示为HSO3- 与Cr O72-反应也可)
2K2O2+2CO2=2K2CO3+O2 Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O(3分) (表示为HSO3- 与Cr O72-反应也可)
【解析】A为第二周期中一种非金属元素,第一电离能大于相邻元素,则A为N元素,B是地壳中含量最多的元素,2P轨道上有二个孤电子,所以B为O元素,D为前四周期中金属性最强的元素,D为K元素,C与B同主族,且原子序数小于K元素,所以C为S元素,E是前四周期中原子核外孤电子数最多的元素,则E为Cr元素。
(1) .C是S元素,位于元素周期表的第3周期VIA族,B是O元素,核外电子排布式为1s22s22p4,E是Cr元素,价电子排布图为![]() ,故答案为:3;VIA;1s22s22p4;
,故答案为:3;VIA;1s22s22p4;![]() ;
;
(2) .元素的非金属性越强,该元素的电负性越强,因非金属性O>S,则两元素的电负性大小关系为:O>S,元素的非金属性越强,其对应的最简单气态氢化物越稳定,因非金属性O>N,则两元素的最简单气态氢化物的稳定性强弱大小关系为:NH3<H2O,故答案为:O>S;NH3<H2O;
(3) .H2O是分子晶体,因O元素的非金属性强,水分子之间存在氢键,则水由固体变为气态时需要克服的微粒间的作用力有范德华力和氢键,故答案为:范德华力、氢键;
(4) .N、O、S三种元素及氢元素组成的既含离子键又含共价键的化合物中应含有铵根离子,S元素的最高正价为+6,则由这四种元素形成的酸式盐的化学式为NH4HSO4,故答案为:NH4HSO4;
(5) .K2O2的电子式为:![]() ,与CO2反应生成O2的化学方程式为:2K2O2+2CO2=2K2CO3+O2,故答案为:
,与CO2反应生成O2的化学方程式为:2K2O2+2CO2=2K2CO3+O2,故答案为:![]() ;2K2O2+2CO2=2K2CO3+O2;
;2K2O2+2CO2=2K2CO3+O2;
(6) .Cr2O72-具有强氧化性,S元素呈+4价的还原性离子为SO32-或HSO3-,根据得失电子守恒和原子守恒,在酸性条件下该反应的离子方程式为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O或Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O,故答案为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O或Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】(1)纯净物可根据其组成和性质进行分类。如图所示的分类方法属于________(填字母)。

A.交叉分类法
B.树状分类法
(2)人们以_________________________________为分类标准分出溶液、胶体和浊液三种体系,请写出实验室制备Fe(OH)3胶体的化学方程式:______________________________;
(3)以H、O、S、N几种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填在下表相应类别中:
物质类别 | 非含氧酸 | 碱 | 酸式盐 | 酸性氧化物 |
化学式 | ____________ | ___________ | ___________ | __________ |
【题目】I.已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入__________________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
II. 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
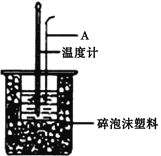
(1)仪器A的名称是__________________,烧杯间填满碎泡沫塑料的作用是__________________。
(2)加入NaOH溶液的正确操作是__________________ (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________________(结果保留一位小数)。
(4)实验中若改用50 mL 0.50 mol/L的盐酸与40 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量__________________(填“相等”“不相等”),若实验操作均正确,则所求中和热__________________(填“相等”“不相等”)。