题目内容
【题目】二氧化氯是一种安全、高效的消毒剂,实验室制取二氧化氯的化学方程式如下:2NaClO3 + Na2SO3 + H2SO4 ![]() 2ClO2↑+ 2Na2SO4 + H2O。下列有关该反应说法正确的是
2ClO2↑+ 2Na2SO4 + H2O。下列有关该反应说法正确的是
A. NaClO3是还原剂 B. Na2SO3被氧化
C. NaClO3失去电子 D. H2SO4发生还原反应
【答案】B
【解析】由反应方程式可知,NaClO3 中的Cl元素从+5价降低为+4价,得到电子,被还原,作氧化剂,Na2SO3 的S元素从+4价升高为+6价,失去电子,被氧化,作还原剂,故A错误,B正确,C错误,D、发生还原反应的是NaClO3 ,H2SO4既没有发生还原反应,也没有发生氧化反应,故D错误。所以本题正确为B。

【题目】I.已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入__________________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
II. 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
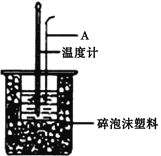
(1)仪器A的名称是__________________,烧杯间填满碎泡沫塑料的作用是__________________。
(2)加入NaOH溶液的正确操作是__________________ (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________________(结果保留一位小数)。
(4)实验中若改用50 mL 0.50 mol/L的盐酸与40 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量__________________(填“相等”“不相等”),若实验操作均正确,则所求中和热__________________(填“相等”“不相等”)。