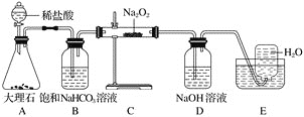
题目内容
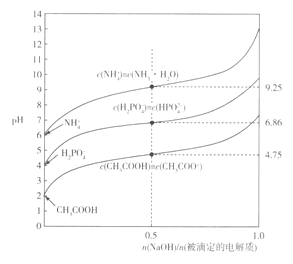
【题目】常温下,用0.10 mol·L-1HCl溶液滴定20 mL 0.050 mol·L-1Na2CO3和0.025 mol·L-1NaHCO3混合溶液,得出如图所示的滴定曲线。下列说法不正确的是

A. a点溶液显碱性的主要原因:CO32-+H2O![]() HCO3-+CH-
HCO3-+CH-
B. b点溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c点溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+ c(Cl-)
D. d点溶液中:c(Na+)> c(Cl-)> c(HCO3-)>c(H+)>c(OH-)
【答案】B
【解析】A. a点溶液0.050mol·L-1 Na2CO3和0.025 mol·L-1 NaHCO3混合溶液,Na2CO3和NaHCO3均能水解使溶液呈碱性,但主要原因是CO32-的水解,故A正确。B. b点加入10mL HCl溶液后,溶液中的溶质为NaHCO3和NaCl,故B错误。C.据电荷守恒可知: c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(Cl-)+ c(OH-),由于c点溶液显中性,c(H+)= c(OH-),所以c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-),故C正确。D. d点加入20mL 0.10mol·L-1HCl溶液后,溶液中c(NaCl)=0.050 mol·L-1,c(NaHCO3)=0.0125mol·L-1,所以c(Na+)>c(Cl-)>c(HCO3-),又因为d点pH<7,所以c(H+)>c(OH-),故D正确。故选B。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-==HCO3-+HCN
B. HCOOH的电离平衡常数表达式为K= c(HCOOH)/[c(HCOO-)·c(H+)]
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. 酸性强弱顺序是HCOOH>HCN>H2CO3
【题目】I.已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入__________________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
II. 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
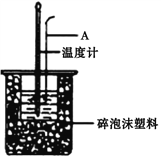
(1)仪器A的名称是__________________,烧杯间填满碎泡沫塑料的作用是__________________。
(2)加入NaOH溶液的正确操作是__________________ (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________________(结果保留一位小数)。
(4)实验中若改用50 mL 0.50 mol/L的盐酸与40 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量__________________(填“相等”“不相等”),若实验操作均正确,则所求中和热__________________(填“相等”“不相等”)。