题目内容
【题目】亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe2+的核外电子排布式__。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有__和__。1molK4[Fe(CN)6]含有σ键为__mol。
(3)黄血盐中N原子的杂化方式为__;C、N、O的第一电离能由大到小的排序为__,电负性由大到小的排序为__。
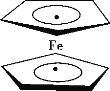
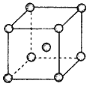
(4)Fe、Na、K的晶体结构如图所示:
①钠的熔点比钾更高,原因是__。
②Fe原子半径是rcm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是__g/cm3。
【答案】1s22s22p63s23p63d6或[Ar]3d6 配位键 离子键 12 sp N>O>C O>N>C Na的半径小,形成的金属键键能大,熔点高 ![]()
【解析】
(1)基态Fe2+的核外有24个电子;
(2)K4[Fe(CN)6]是离子化合物,Fe2+与CN-之间通过配位键结合;
(3)黄血盐中N原子形成1个σ键、2个π键,有1对孤电子对; N原子2p轨道为半充满,结构稳定;同周期元素从左到右,元素的电负性依次增大;
(4)①钠的半径比钾小;
②Fe为体心立方堆积,晶胞的体对角线=4r;
(1) Fe2+的核外有24个电子,基态Fe2+的核外电子排布式1s22s22p63s23p63d6;
(2)K4[Fe(CN)6]是离子化合物,Fe2+与CN-之间通过配位键结合,除共价键外,还有离子键和配位键;1molK4[Fe(CN)6]中CN含有C、N三键,其中1个是σ键,N原子有孤对电子,铁原子有空轨道,所以每个铁离子与CN-形成6个配位键,共6个σ键,结构如下: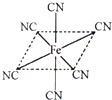 ,所以1molK4[Fe(CN)6]含有σ键为12mol。
,所以1molK4[Fe(CN)6]含有σ键为12mol。
(3)黄血盐中N原子形成1个σ键、2个π键,有1对孤电子对,N原子的杂化方式为sp;N原子2p轨道为半充满,结构稳定,C、N、O的第一电离能由大到小的排序为N>O>C;同周期元素从左到右,元素的电负性依次增大,C、N、O电负性由大到小的排序为O>N>C;
(4)①Na的半径小,形成的金属键键能大,所以钠的熔点比钾更高;
②Fe原子半径是rcm,Fe为体心立方堆积,晶胞的体对角线=4r;则晶胞的边长是![]() cm,铁的相对原子质量为a,1个晶胞中铁原子数是
cm,铁的相对原子质量为a,1个晶胞中铁原子数是![]() ,则铁单质的密度是
,则铁单质的密度是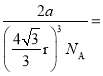
![]() g/cm3。
g/cm3。

 名校课堂系列答案
名校课堂系列答案【题目】常温下,有关物质的溶度积如下,下列有关说法不正确的是( )
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.60×10-12 | 2.80×10-39 |
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.0×10-21
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.0×10-2mol/L],若保持温度不变,向其中加入100mL0.012mol/L的NaOH,则该溶液变为不饱和溶液