题目内容
【题目】采用科学技术减少氮氧化物等物质的排放可促进社会主义生态文明建设。
(1)用CH4催化还原氮氧化物的相关热化学方程式如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-662 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l) △H=-1248 kJ/mol
反应CH4(g)+2NO2(g)= N2(g) +CO2(g)+2H2O(l) △H=________kJ/mol
(2)氮氧化物可用碱溶液吸收。NO和NO2混合气体按一定比例被NaOH溶液完全吸收生成NaNO2和H2O,写出该反应的化学方程式________;若反应过程中消耗NaOH的物质的量为3 mol,则理论上被吸收的NO和NO2混合气体的总体积在标准状况下为________L。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
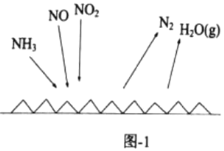
①由图1可知SCR技术中的还原剂为________。
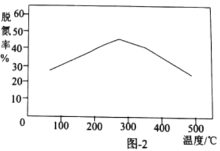
②一定时间内,用Fe作催化剂,氨气按一定的比例催化还原氮氧化物时,不同温度下的脱氮率如图2所示,温度高于300℃时,脱氮率随温度的升高而下降的原因可能是________。
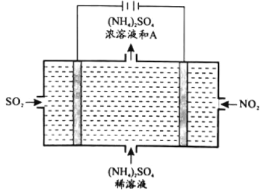
(4)利用反应6NO2+8NH3=7N2+12H2O设计成原电池,既能减轻氮氧化物对环境的污染,又能充分利用化学能,装置如图3所示。
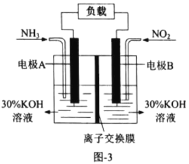
①电极B是________极(填“正”或者“负”)。
②A电极的电极反应式为________。
【答案】-955 NO+NO2+2NaOH=2NaNO2+H2O 67.2 NH3 随着温度升高催化剂活性降低,所以脱氮率随温度的升高而下降。 正 2NH3-6e-+6OH-=N2+6H2O
【解析】
(1)根据盖斯定律,将已知热化学方程式叠加,可得待求反应的热化学方程式;
(2)根据元素守恒、电子守恒书写反应方程式;根据NaOH的物质的量与反应消耗气体物质的量关系计算气体的物质的量,然后根据n=![]() 计算气体在标准状况下的体积;
计算气体在标准状况下的体积;
(3)①根据还原剂失去电子,元素化合价升高分析判断;
②利用催化剂在一定温度下催化效率最高分析判断;
(4)根据在原电池反应中负极失去电子,发生氧化反应,正极上得到电子,发生还原反应分析解答。
(1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-662 kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l) △H=-1248 kJ/mol
根据盖斯定律,将(①+②)×![]() ,整理可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol;
,整理可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol;
(2)NO和NO2混合气体按一定比例被NaOH溶液完全吸收生成NaNO2和H2O,则根据元素原子守恒、电子守恒,可得该反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O;由方程式可知:NaOH的物质的量与反应消耗气体的物质的量相等,若反应过程中消耗NaOH的物质的量为3 mol,则理论上被吸收的NO和NO2混合气体的物质的量也是3 mol,其在标准状况下的总体积V(NO+NO2)=3 mol×22.4 L/mol=67.2 L;
(3)①根据图示可知NH3与NO、NO2发生反应产生N2、H2O,在反应中NH3中N元素化合价为-3价,反应后变为N2中的0价,化合价升高,失去电子,被氧化,所以NH3为还原剂;
②一定时间内,用Fe作催化剂,氨气按一定的比例催化还原氮氧化物时,温度不同,反应脱氮率不同,催化剂只有在一定温度范围内催化效率最高,当温度高于300℃时,脱氮率随温度的升高而下降的原因可能是由于随着温度升高催化剂活性降低,导致脱氮率随温度的升高而下降;
(4)①根据图示可知:电极A上通入NH3,失去电子,发生氧化反应变为N2,所以A电极为负极;电极B上通入NO2,得到电子,发生还原反应变为N2,所以B电极为正极;
②电极A上通入NH3,失去电子,发生氧化反应变为N2,其中的+1价的H与溶液中OH-结合形成H2O,则A电极为负极,负极A的电极反应式为:2NH3-6e-+6OH-=N2+6H2O。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】常温下,有关物质的溶度积如下,下列有关说法不正确的是( )
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.60×10-12 | 2.80×10-39 |
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.0×10-21
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.0×10-2mol/L],若保持温度不变,向其中加入100mL0.012mol/L的NaOH,则该溶液变为不饱和溶液