题目内容
3.短周期金属元素甲~戊在元素周期表中的相对位置如表所示.下列判断正确的是( )| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:丙>丁>戊 | B. | 金属性:甲>丙 | ||
| C. | 氢氧化物碱性:丙>丁>戊 | D. | 最外层电子数:甲>乙 |
分析 由短周期金属元素甲~戊在元素周期表的相对位置,可知甲为Li、乙为Be、丙为Na、丁为Mg、戊为Al.
A.同周期随原子序数增大,原子半径减小;
B.同主族自上而下金属性增强;
C.金属性越强,最高价氧化物对应水化物的碱性越强;
D.同周期自左而右最外层电子数增大.
解答 解:由短周期金属元素甲~戊在元素周期表的相对位置,可知甲为Li、乙为Be、丙为Na、丁为Mg、戊为Al.
A.同周期随原子序数增大,原子半径减小,故原子半径:丙>丁>戊,故A正确;
B.甲、丙同主族,自上而下金属性增强,故金属性:甲<丙,故B错误;
C.同周期自左而右金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强,故最高价氧化物对应水化物的碱性:丙>丁>戊,故C正确;
D.同周期自左而右最外层电子数增大,甲、乙同周期,乙的原子序数较大,故乙的最外层电子数较多,故D错误,
故选AC.
点评 本题考查元素周期表与元素周期律,比较基础,注意对元素周期表的整体把握,掌握同周期、同主族元素化合物性质相似性与递变性.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
14.如图是产生和收集气体的实验装置,该装置适合于( )


| A. | 用浓硝酸与Cu反应制取NO2 | B. | 用浓盐酸和MnO2反应制取Cl2 | ||
| C. | 用H2O2溶液和MnO2反应制取O2 | D. | 用NH4Cl和Ca(OH)2反应制取NH3 |
11.在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g)?4C(g)+5D(g).若经5s后,剩下的A是2.5mol,则A的反应速率是( )
| A. | 0.45 mol/(L•s) | B. | 0.15 mol/(L•s) | C. | 0.225 mol/(L•s) | D. | 0.9 mol/(L•s) |
18.表是元素周期表的一部分,有关说法正确的是( )
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | c | d | |||||
| 3 | a | b | e | f |
| A. | e的氢化物比d的氢化物稳定 | |
| B. | a、b、e三种元素的原子半径:e>b>a | |
| C. | 六种元素中,c元素单质的化学性质最活泼 | |
| D. | c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
15.下列实验操作可以达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 验证乙炔能被酸性高锰酸 钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性 高锰酸钾溶液,观察溶液是否褪色 |
| B | 验证苯和液溴在FeBr3的 催化下发生取代反应 | 将反应产生的混合气体通入AgNO3溶液上方, 观察是否有淡黄色沉淀生成 |
| C | 除去乙酸乙酯中混有的少 量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液, 取出上层液体 |
| D | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝 酸银溶液,观察是否出现淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
12.中学常见物质A、B、C、D、E、X,存在图中转化关系(部分生成物和反应条件略去).下列推断不正确的是( )


| A. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是氯气 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D为NaCl,且A可与C反应生成B,则E一定是CO2 | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
12.用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,下列操作会造成测定结果偏高的原因是( )
| A. | 未用标准液润洗碱式滴定管 | |
| B. | 滴定终点读数时,俯视滴定管的刻度 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
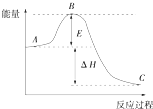 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g) 被氧化为1mol SO3(g)的△H=-99kJ/mol.回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g) 被氧化为1mol SO3(g)的△H=-99kJ/mol.回答下列问题: 已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化关系如图所示,反应①~④均为化合反应.回答下列问题:
已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化关系如图所示,反应①~④均为化合反应.回答下列问题: