题目内容
3.下列说法不正确的是( )| A. | CF4、CCl4、CBr4、CI4的熔点沸点升高与范德华力有关 | |
| B. | H2O的熔、沸点大于H2S的是由于H2O之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 分子晶体中分子一定紧密堆积 |
分析 A、CF4、CCl4、CBr4、CI4都是分子晶体,所以熔点沸点高低与相对分子量的大小有关;
B、水分子间存在氢键,而硫化氢分子间无氢键;
C、乙醇与水都是极性分子;
D、冰中水分子间存在氢键,不具有分子密堆积特征.
解答 解:A、CF4、CCl4、CBr4、CI4都是分子晶体,所以熔点沸点高低与相对分子量的大小有关,而CF4、CCl4、CBr4、CI4的相对分子量逐渐增加同,所以熔点沸点升高,故A正确;
B、水分子间存在氢键,而硫化氢分子间无氢键,所以H2O的熔、沸点大于H2S的熔、沸点,故B正确;
C、乙醇与水都是极性分子,根据相似相溶原理乙醇与水互溶,故C正确;
D、冰中水分子间存在氢键,氢键具有方向性,所以分子晶体冰不具有分子密堆积特征,故D错误;
故选D.
点评 本题考查氢键的存在及对物质性质的影响、相似相溶原理,难度不大,学生在解题中要注意氢键对物质熔沸点的影响.

练习册系列答案
相关题目
18.用惰性电极电解浓度为0.1mol/L的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2和9gH2O时,恰好恢复电解前的浓度和pH.则下列说法正确的是( )
| A. | 电解过程中共转移电子1.4mol | |
| B. | 原硫酸铜溶液的体积为1L | |
| C. | 在这个过程中共生成6.4gCu和0.5molO2 | |
| D. | 电解过程中阴极有0.3molH2生成 |
8.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=13的溶液:K+、Na+、Cl-、SiO32- | |
| B. | c(H+)/c(OH-)=1×10-14的溶液:Na+、NH4+、Cl-、SO42- | |
| C. | 0.1mol•L-1的Na2CO3溶液:Na+、Ca2+、I-、SO42- | |
| D. | 加入石蕊呈蓝色的溶液:Na+、Al3+、Cl-、NO3- |
15.有铜和氧化铁的混合物a g,当慢慢滴入2mol/L的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解.若将a g该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为( )
| A. | 等于(a-0.8 )g | B. | 大于(a-0.8 )g | C. | 大于(a-2.67)g | D. | 等于(a-2.67)g |
12. 试运用所学知识,研究CO等气体的性质,请回答:
试运用所学知识,研究CO等气体的性质,请回答:
(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
反应③的平衡常数表达式为K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;上述反应中△H1、△H2、△H3之间的关系为△H1+△H2═△H3或△H2═△H3-△H1,或△H1═△H3-△H2.
(2)不同温度下反应②的平衡常数如表所示.则△H2< 0(填“<”“>”);
在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mo/L,则CO的平衡转化率为75%.
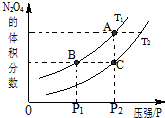
(3)对于反应2NO2(g)?N2O4(g)△H<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.则T1<T2(填“>”或“<”);增大压强,平衡向正反应方向反应方向移动;B、C两点的平衡常数B>C(填“>”或“<”).
 试运用所学知识,研究CO等气体的性质,请回答:
试运用所学知识,研究CO等气体的性质,请回答:(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
反应③的平衡常数表达式为K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;上述反应中△H1、△H2、△H3之间的关系为△H1+△H2═△H3或△H2═△H3-△H1,或△H1═△H3-△H2.
(2)不同温度下反应②的平衡常数如表所示.则△H2< 0(填“<”“>”);
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(3)对于反应2NO2(g)?N2O4(g)△H<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.则T1<T2(填“>”或“<”);增大压强,平衡向正反应方向反应方向移动;B、C两点的平衡常数B>C(填“>”或“<”).
2.下列有机化学方程式书写完全正确的是( )
| A. | TNT的制备: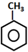 +3HNO3$→_{100℃}^{浓硫酸}$ +3HNO3$→_{100℃}^{浓硫酸}$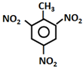 +3H2O +3H2O | |
| B. | 溴乙烷的消去反应:C2H3Br+NaOH$→_{△}^{水}$C2H4↑+NaBr+H2O | |
| C. | 乙醇氧化成乙醛:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O | |
| D. | 乙酸乙酯在碱性条件下水解:CH3COOC2H5+H2O$?_{△}^{碱性}$CH3C0OH+C2H5OH |
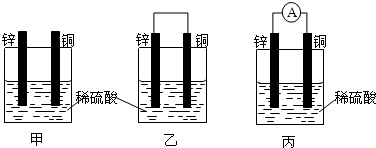
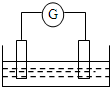 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: E的元素符号是Cl.
E的元素符号是Cl.