题目内容
18.用惰性电极电解浓度为0.1mol/L的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2和9gH2O时,恰好恢复电解前的浓度和pH.则下列说法正确的是( )| A. | 电解过程中共转移电子1.4mol | |
| B. | 原硫酸铜溶液的体积为1L | |
| C. | 在这个过程中共生成6.4gCu和0.5molO2 | |
| D. | 电解过程中阴极有0.3molH2生成 |
分析 根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,Cu(OH)2从组成上可看成CuO•H2O,加入0.1 mol Cu(OH)2和9g(即0.5mol)H2O时后恰好恢复到电解前的浓度和pH,即电解消耗0.1molCuSO4,并电解了0.1+0.5=0.6 mol H2O,据此分析.
解答 解:Cu(OH)2从组成上可看成CuO•H2O,加入0.1 mol Cu(OH)2和9g(即0.5mol)H2O时后恰好恢复到电解前的浓度和pH,即电解消耗0.1molCuSO4,并电解了0.1+0.5=0.6 mol H2O,由电解的总反应式:
2H2O+2CuSO4$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 转移电子
2mol 2mol 1mol 4mol
0.1mol 0.1mol 0.05mol 0.2mol
2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑转移电子
2mol 2mol 1mol 4mol
0.6mol 0.6mol 0.3mol 1.2mol
A、根据以上分析,电解过程中共转移电子0.2+1.2=1.4mol,故A正确;
B、根据以上分析,原溶液中含铜离子为0.1mol,所以体积V=$\frac{0.1mol}{0.1mol/L}$=1L,故B正确;
C、根据以上分析,生成0.1mol铜即6.4g,氧气为0.05+0.3=0.35mol,故C错误;
D、根据以上分析,阴极有0.6molH2生成,故D错误;
故选:AB.
点评 本题考查电解池的工作原理,先根据出什么加什么判断电解的过程,再根据电解方程式进行计算,难度一般.

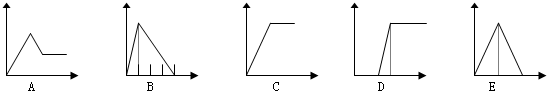
| 溶液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | 通CO2至过量 | E |
| (2)AlCl3溶液 | 通过量的NH3 | C |
| (3)含少量HCl的AlCl3溶液 | 通过量的NH3 | D |
| (4)NaAlO2溶液 | 滴加稀HCl至过量 | B |
| (5)MgCl2 和AlCl3的混和液 | 滴加NaOH至过量 | A |
| 物质(杂质) | 除去杂质 所需试剂或方法 | 离子方程式(若无离子方程式,则写化学方程式) |
| Fe(Al) | ||
| CO2(HCl) | ||
| NaHCO3溶液(Na2CO3) | ||
| Al2O3(Al(OH)3) |
| A. | CF4、CCl4、CBr4、CI4的熔点沸点升高与范德华力有关 | |
| B. | H2O的熔、沸点大于H2S的是由于H2O之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 分子晶体中分子一定紧密堆积 |
| A. | 常温常压下,11.2L 二氧化硫气体中含有0.5NA个SO2分子 | |
| B. | 常温下,3.2g硫与足量铁粉充分反应,转移的电子数为0.2 NA个 | |
| C. | 1 mol 苯分子中含有3 NA个碳碳双键 | |
| D. | 0.1mol•L-1的Na2S溶液中含有0.2NA个Na+离子 |
| A. | 该病毒主要通过血液向他人传染 | |
| B. | 该病毒在浓盐溶液中一定会发生变性 | |
| C. | 通常将病毒样本保存在福尔马林中 | |
| D. | 该病毒在一定条件下水解最终会生成氨基酸 |
 ,请推测其具有的化学性质,填写下列空白:
,请推测其具有的化学性质,填写下列空白: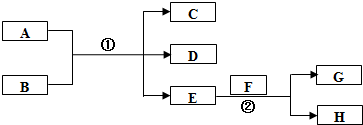
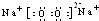 ;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.
;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.