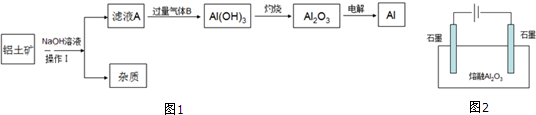
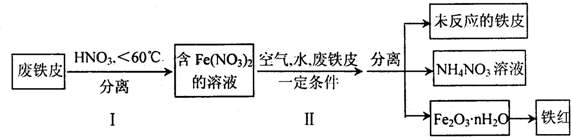
题目内容
9.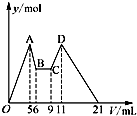 有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题:
有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题:①上述 HCl溶液的浓度c=1.5mol/L
②所加NaOH溶液的体积为C
A.9mL B.7.5mL C.7mL D.6mL.
分析 ①又由图可知,5→6(1 mL)、9→11(2 mL)分别是溶解Al(OH)3和使AlO2-恰好完全生成Al(OH)3沉淀消耗的NaOH和HCl.根据铝元素守恒:
NaOH-Al(OH)3-AlO2--H+
1 1 1 1
由此可以推出:c(NaOH):c(HCl)=2:1,由此求出HCl溶液的浓度;
②依据图象分析在BC段的意义是加入的氢氧化钠溶液和加入盐酸溶液体积之和,依据酸碱反应定量关系,酸碱溶液浓度关系计算得到氢氧化钠溶液体积;
解答 解:①又由图可知,5→6(1 mL)、9→11(2 mL)分别是溶解Al(OH)3和使AlO2-恰好完全生成Al(OH)3沉淀消耗的NaOH和HCl.根据铝元素守恒:
NaOH-Al(OH)3-AlO2--H+
1 1 1 1
由此可以推出:c(NaOH):c(HCl)=2:1,所以HCl溶液的浓度c=1.5mol/L,故答案为:1.5;
②依据图象分析可知,BC段是加入的氢氧化钠溶液,加入盐酸和氢氧化钠溶液反应,此段中设氢氧化钠溶液体积V1,盐酸体积为V2,得到V1 +V2=3,酸碱中和反应物质的量相同,C1=2C2,V1C1=C2V2,2V1=V2,得到V1=1ml,则加入氢氧化钠溶液体积=6ml+1ml=7ml;
故选:C.
点评 本题考查了镁、铝重要化合物的性质,题目难度较大,能正确分析图象中转折线发生的化学反应是解本题的关键,试题有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.

练习册系列答案
相关题目
17.用于制造隐形飞机物质具有吸收微波的功能,其主要成分的结构如图,说法不正确的是( )
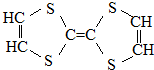

| A. | 它属于烃的衍生物 | B. | 所有的碳杂化方式相同 | ||
| C. | 属于高分子化合物 | D. | 它可以与氢气加成 |
4.国际著名血液学杂志《BLOOD》刊载了一条令人振奋的科研成果:中国科学家找到白血病致病元凶--蛋白质Shp2.下列关于蛋白质Shp2的说法中正确的是( )
| A. | 它是高分子化合物 | |
| B. | 它在一定条件下能水解,最终生成葡萄糖 | |
| C. | 是天然蛋白质,仅由C、H、O、N四种元素组成 | |
| D. | 是一种特殊的蛋白质,滴加浓HNO3不发生颜色反应,灼烧时没有任何气味 |
14.可逆反应:2NO2(g)?2NO(g)+O2(g)在一固定容积的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时,生成2nmolNO
③用NO2、NO、O2物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时,生成2nmolNO
③用NO2、NO、O2物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
| A. | ②③⑤ | B. | ①④⑥ | C. | ①③④ | D. | ①②③④⑤⑥ |
1.下列说法正确的是( )
| A. | 2-丁烯不存在顺反异构体 | |
| B. | 已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为六种 | |
| C. | 菲的结构简式为 ,它与硝酸反应,可生成4种一硝基取代物 ,它与硝酸反应,可生成4种一硝基取代物 | |
| D. | 乙醇的核磁共振氢谱中有三个峰,峰面积之比是l:2:3 |