题目内容
20.Al是生活中常见的金属,工业上制备金属铝的原料可从铝土矿(主要成分是Al2O3,MgO,Fe2O3等)中提取,其流程如图1,请回答下列问题: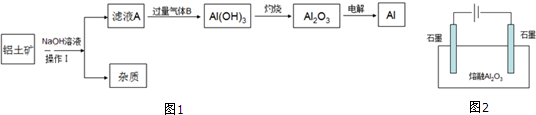
(1)操作Ⅰ是,气体B的化学式是CO2
(2)由滤液A生成Al(OH3的离子方程式是AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
(3)工业上采用图2装置电解熔融Al2O3制备金属铝,该电解池阳极的电极反应为2O2--4e-═O2↑,若电解一段时间后,阳极的石墨损失了54g,且生成的CO与CO2的物质的量之比为2:1,则阴极生成的产物质量为108g.
(4)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,则Be(OH)+与强碱溶液反应的离子方程式为:Be(OH)++3OH-═BeO22-+2H2O,研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是bc.
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液.
分析 铝土矿(主要成分是Al2O3,MgO,Fe2O3等)中加入氢氧化钠溶液后过滤,得杂质中主要含有MgO,Fe2O3,滤液A为偏铝酸钠溶液,通入过量气体B得氢氧化铝沉淀,则气体B为CO2,氢氧化铝受热分解得氧化铝,电解熔融的氧化铝得铝,
(1)分离固体和液休通常用过滤操作,根据上面分析可知B的化学式;
(2)偏铝酸钠溶液中通入过量二氧化碳气体得氢氧化铝沉淀;
(3)电解熔融Al2O3制备金属铝中,电解池阳极是氧离子得电子生成氧气,根据元素守恒和电子守恒计算产物质量;
(4)根据铝元素的性质推断铍的性质,写出离子方程式;比较元素的金属性强弱,可根据金属与水、酸反应的剧烈程度、对应的最高价氧化物的水化物的碱性强弱、单质间的置换反应等判断,以此解答该题.
解答 解:铝土矿(主要成分是Al2O3,MgO,Fe2O3等)中加入氢氧化钠溶液后过滤,得杂质中主要含有MgO,Fe2O3,滤液A为偏铝酸钠溶液,通入过量气体B得氢氧化铝沉淀,则气体B为CO2,氢氧化铝受热分解得氧化铝,电解熔融的氧化铝得铝,
(1)分离固体和液休通常用过滤操作,根据上面分析可知B的化学式为,
故答案为:过滤;CO2;
(2)偏铝酸钠溶液中通入过量二氧化碳气体得氢氧化铝沉淀,反应的离子方程式是AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)电解熔融Al2O3制备金属铝中,电解池阳极是氧离子得电子生成氧气,阳极的电极反应为2O2--4e-═O2↑,
设CO的物质的量为xmol,CO2的物质的量为ymol,根据题意有$\left\{\begin{array}{l}{12x+12y=54}\\{x:y=1:2}\end{array}\right.$,所以x=3mol,y=1.5mol,反应中电子转移的物质的量为3×2mol+1.5×4mol=12mol,根据阴极反应2Al3++6e-═2Al可知,阴极上生成的铝的质量为$\frac{12}{3}×27$g=108g,
故答案为:2O2--4e-═O2↑;108;
(4)根据铝元素的性质推断铍的性质,可知Be(OH)+与强碱溶液反应的离子方程式为:Be(OH)++3OH-═BeO22-+2H2O,
a.硬度和熔点属于物理性质,不能用于比较金属性,故A错误;
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠,氯化镁生成沉淀氢氧化镁,氢氧化铝会溶解在氢氧化钠中,证明碱性:氢氧化镁强于氢氧化铝,所以能证明金属性强弱,故B正确;
c、将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液,发现放镁带的那个变红色,证明金属镁可以和热水反应,但是金属铝不可以,能证明金属性强弱,故C正确,故选bc,
故答案为:bc;Be(OH)++3OH-═BeO22-+2H2O.
点评 本题考查较为综合,涉及物质的制备方案的设计与评价,注意把握制备原理的比较,把握物质的性质以及相关反应方程式的书写,难度中等.

 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| A. | 气体分子的摩尔质量 | B. | 微粒本身的大小 | ||
| C. | 微粒的质量 | D. | 微粒间的平均距离 |
| A. | 往澄清石灰水中通入过量的CO2:OH-+CO2═HCO3- | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 小苏打与醋酸反应:HCO3-+2H+═H2O+CO2↑ |
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2S04溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)请将KMnO4氧化Fe2+的离子方程式补充完整:
□MnO4-+□Fe2++□8H+=□Mn2++□Fe3++□4H2O
(3)生成各种氢氧化物沉淀的pH如下表(金属离子的起始浓度为0.1mol•L-1)
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
| A. | 钚电池是将核能转化为电能 | |
| B. | 放射源一端为正极,集电器一端为负极 | |
| C. | 核源料是可再生能源 | |
| D. | ${\;}_{94}^{238}$Pu的原子质量是12 C原子质量的238倍 |

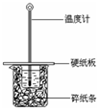 某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.
某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.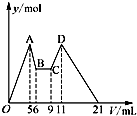 有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题:
有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题: