题目内容
16.化学计量在化学中占有重要地位,请回答下列问题:(1)现有mg某气体,它由双原子分子构成,其摩尔质量为Mg•mol-1.若阿伏加德罗常数用NA表示,该气体所含原子总数为$\frac{2m{N}_{A}}{M}$个;
(2)与标准状况下2.24LCO2所含氧原子数目相同的水的质量是3.6g.
(3)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是XY3.
分析 (1)由n=$\frac{m}{M}$计算气体物质的量,原子物质的量为气体分子2倍,再根据N=nNA计算原子数目;
(2)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$计算;
(3)一定温度与压强下,气体的体积之比等于物质的量之比,等于化学计量数之比,然后利用质量守恒定律来确定化学式.
解答 解:(1)mg气体的物质的量=$\frac{mg}{Mg/mol}$=$\frac{m}{M}$mol,由双原子分子构成,原子物质的量为气体分子2倍,故含有原子数目=$\frac{m}{M}$mol×2×NAmol-1=$\frac{2m{N}_{A}}{M}$,
故答案为:$\frac{2m{N}_{A}}{M}$;
(2)2.24LCO2的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,n(O)=2×0.1mol=0.2mol,则n(H2O)=0.2mol,m(H2O)=0.2mol×18g/mol=3.6g,
故答案为:3.6;
(3)一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,设该化合物为Z,由气体的体积之比等于物质的量之比,等于化学计量数之比,
则X2+3Y2═2Z,由原子守恒可知,Z为XY3,
故答案为:XY3.
点评 本题考查物质的量、阿伏伽德罗定律及其推论有关计算,明确一定温度与压强下气体体积与化学计量数的关系、熟悉基本计算公式即可解答,题目难度不大.

练习册系列答案
相关题目
7.影响一定数量气体体积大小的主要因素是( )
| A. | 气体分子的摩尔质量 | B. | 微粒本身的大小 | ||
| C. | 微粒的质量 | D. | 微粒间的平均距离 |
4.下列说法中,不正确的是( )
| A. | 氢氧化铁胶体中分散质微粒直径为1~100nm | |
| B. | 可用丁达尔现象判断胶体的制备是否成功 | |
| C. | 溶液一定是均一、稳定的混合物 | |
| D. | 长期放置后不会分层的液体,就是溶液 |
11.常温下,向浓度为0.1mol•L-1硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示.a、b、c、d分别表示实验时不同阶段的溶液,下列有关叙述中不正确的是( )

| A. | 溶液的pH:a<b<c<d | B. | 溶液的导电性:c<d | ||
| C. | a、b溶液呈酸性 | D. | c、d溶液呈碱性 |
1.潮湿的氯气、新制的氯水、次氯酸钠、漂白粉溶液均能使有色布条褪色,这是由于它们含有或能生成( )
| A. | 氯气 | B. | 次氯酸 | C. | 氢气 | D. | 氯化氢 |
8.下列反应的离子方程式书写正确的是( )
| A. | 往澄清石灰水中通入过量的CO2:OH-+CO2═HCO3- | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 小苏打与醋酸反应:HCO3-+2H+═H2O+CO2↑ |
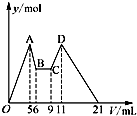 有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题:
有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题: