题目内容
18.为了完成教材上的“中和热的测定”实验,(1)实验桌上有烧杯(大、小两个)、泡沫橡胶、泡沫塑料板、环形玻璃搅拌器,0.5mol•L-1盐酸、0.55mol•L-1NaOH溶液,尚缺少的实验用品是量筒和温度计.
(2)实验中能否用环形铜丝搅拌器代替环形玻璃搅拌器?否(填“能”或“否”).其原因是铜丝的导热性比玻璃好,热量损失得多.
(3)实验时所用盐酸及NaOH溶液的体积均为40mL,各溶液密度为1g•cm-3,生成溶液的比热容c=4.2J/(g•℃),实验起始温度为t1℃,终止温度为t2℃.试推断中和热的计算式(不用化简):△H=-$\frac{{4.18×{{10}^{-3}}×80×({t_2}-{t_1})}}{0.02}$kJ/mol.
(4)实验过程中如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的中和热△H偏大.(填“偏大”“偏小”或“无影响”).
(5)0.50L 1.00mol/L H2SO4溶液与1.00L 1.00mol/L NaOH溶液完全反应,放出57.3kJ的热量,写出该中和反应的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3KJ/mol.
分析 (1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(2)金属导热快,热量损失多;
(3)先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出中和热;
(4)中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,温度差偏小;
(5)根据物质的量与热量成正比以及热化学方程式的书写方法来解答.
解答 解:(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少温度计和量筒,
故答案为:量筒;温度计;
(2)不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝的导热性比玻璃好,热量损失得多,
故答案为:否;铜丝的导热性比玻璃好,热量损失得多;
(3)用40mL 0.5mol•L-1盐酸与40mL 0.55mol•L-1NaOH溶液进行中和反应生成水的物质的量为0.04L×0.5mol•L-1=0.02mol,溶液的质量为80ml×1g/ml=80g,温度变化的值为t2-t1,则生成0.02mol水放出的热量为Q=m•c•△T=4.18J/(g•℃)×100mL×1g/cm3(t2-t1),所以实验测得的中和热△H=-$\frac{{4.18×{{10}^{-3}}×80×({t_2}-{t_1})}}{0.02}$kJ/mol;
故答案为:-$\frac{{4.18×{{10}^{-3}}×80×({t_2}-{t_1})}}{0.02}$kJ/mol;
(4)中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,温度差偏小,热量偏小,但测得的中和热偏大;
故答案为:偏大;
(5)0.50L 1.00mol/L H2SO4溶液与1.00L 1.00mol/L NaOH溶液完全反应,放出57.3kJ的热量,即生成1mol水时放出57.3kJ的热量,则热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3KJ/mol;
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3KJ/mol.
点评 本题考查学生有关中和热的测定知识,可以根据所学知识进行回答,注意对中和热概念的理解,难度不大

| 酸 | 碱 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 盐酸 | 纯碱 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 硫酸 | 烧碱 | 食盐 | 氧化钙 | 一氧化碳 |
| C | 醋酸 | 苛性碱 | 小苏打 | 一氧化碳 | 二氧化硫 |
| D | 硫酸 | 苛性钾 | 苏打 | 氧化铜 | 三氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 钚电池是将核能转化为电能 | |
| B. | 放射源一端为正极,集电器一端为负极 | |
| C. | 核源料是可再生能源 | |
| D. | ${\;}_{94}^{238}$Pu的原子质量是12 C原子质量的238倍 |
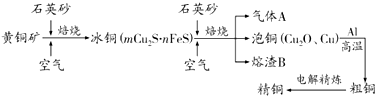
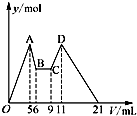 有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题:
有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题: