题目内容
13.(1)用“>”、“<”或“=”填写下列空格:①键能:H2S<H2O
②键角:BCl3>NCl3
③原子的核外电子排布中,未成对电子数:25Mn>27Co
④A元素的电子构型为ns2np3,B元素的电子构型为ns2np4,第一电离能:A>B
(2)短周期元素中原子核外p轨道上电子数与s轨道上电子总数相等的元素是O、Mg(写元素符号).
(3)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(4)下列微粒:①CH4;②CH≡CH;③NH4+;④BF3;⑤H2O填写下列空白(填序号)呈正四面体的是①③. 所有原子共平面的是②④⑤,共线的是②.
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子,写出该配离子的结构简式(标明配位键)
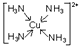 .已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.
.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.
分析 (1)①原子半径越小,共价键的键能越大;
②元素的非金属性越强,最高价氧化物对应水化物酸性越强;
③根据分子的空间构型来判断;
④根据同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;
(2)当s轨道上电子总数为4时,则p轨道上电子数也为4,即1s22s22p4;当s轨道上电子总数为6时,则p轨道上电子数也为6,即1s22s22p63s2;
(3)在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9;
(4)根据分子的空间构型分析;
(5)中心原子提供空轨道,配体提供孤电子对,配合物中配位键由配体指向中心原子;NF3分子中氟原子电负性强,吸引孤对电子能力强.
解答 解:(1)①原子半径越小,共价键的键能越大,所以键能:H2S<H2O,故答案为:<;
②BCl3的空间构型为平面三角形,键角为120°,BCl3的分子构型为三角锥形,键角为107°,所以键角:BCl3>NCl3,故答案为:>;
③27Cr核外电子排布式:1s22s22p63s23p63d74s2,未成对电子数为3,25Mn核外电子排布式:1s22s22p63s23p63d54s2,未成对电子数为5,所以未成对电子数:25Mn>27Con,故答案为:>;
④元素的电子构型为ns2np3,为第ⅤA族,电子排布为半满状态,较稳定,不易失去电子,所以第一电离能较大,B元素的电子构型为ns2np4,为第ⅥA族,所以第一电离能:A>B,
故答案为:>;
(2)当s轨道上电子总数为4时,则p轨道上电子数也为4,即1s22s22p4为O元素,当s轨道上电子总数为6时,则p轨道上电子数也为6,即1s22s22p63s2为Mg元素;
故答案为:O、Mg;
(3)在基态Ti2+中,核外电子排布为1s22s22p63s23p63d2,电子占据的最高能层符号为M,该能层具有的原子轨道数为9,故答案为:M;9;
(4)①CH4是正四面体结构;②CH≡CH是直线形分子,所有原子共平面也共线;③NH4+是正四面体结构;④BF3是平面三角形分子,所有原子共平面而不共线;⑤H2O是V形分子,所有原子共平面而不共线,故答案为:①③;②④⑤;②;
(5)在配合物离子[Fe(SCN)]2+中,中心离子是Fe3+,提供提供空轨道接受孤对电子,配合物离子[Cu(NH3)4]2+中的配位键为 ;NF3分子中氟原子电负性强,吸引电子能力强,共用电子对偏向F而偏离N原子,使得氮原子上的孤对电子难于与Cu2+形成配位键;
;NF3分子中氟原子电负性强,吸引电子能力强,共用电子对偏向F而偏离N原子,使得氮原子上的孤对电子难于与Cu2+形成配位键;
故答案为: ;共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.
;共用电子对偏向F而偏离N原子,使得N原子上的孤对电子难于与Cu2+形成配位键.
点评 本题是对物质结构的考查,涉及键能、核外电子排布、第一电离能、配合物性等,是对主干知识的考查,需要学生具备扎实的基础,难度中等.

| A. | Ka=$\frac{2×1{0}^{-7}}{0.1V-2}$ | B. | V=$\frac{2×1{0}^{-7}}{0.1Ka-2}$ | ||
| C. | K a=$\frac{2×1{0}^{-7}}{V+20}$ | D. | K a=$\frac{2×1{0}^{-8}}{V}$ |
| 编号 | ① | ② | ③ | ④ |
| 物质 | AlF3 | AlCl3 | BCl3 | NCl3 |
| 熔点/℃ | 1291 | 160 | -107 | -40 |
| A. | BCl3、NCl3分子中各原子最外层都满足8电子稳定结构 | |
| B. | NCl3中心原子价层电子对数比BCl3中心原子价层电子对数多 | |
| C. | AlF3、AlCl3都是强电解质,但晶体类型不同 | |
| D. | BCl3为平面正三角形分子,故它是由极性键构成的非极性分子 |
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
 请完成下列各题:
请完成下列各题:
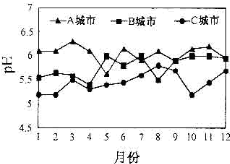 A、B、C三个城市全年雨水的月平均pH变化如图所示.
A、B、C三个城市全年雨水的月平均pH变化如图所示.