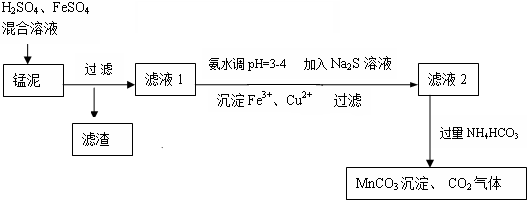
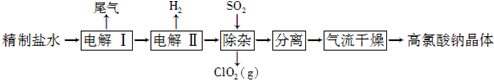
题目内容
9.线型弹性材料“丁苯吡橡胶”的结构简式如下: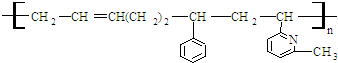
其单体可能是:
①
 ②CH2=CH
②CH2=CH ③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
⑤CH2═CH
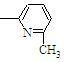 ⑥CH2=CH
⑥CH2=CH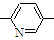 CH3
CH3正确的组合是( )
| A. | ②③⑥ | B. | ②③⑤ | C. | ①②⑥ | D. | ②④⑥ |
分析 在高分子链中,单体转变为在化学组成上能够重复的最小单位,即链节.判断高聚物的单体,就是根据高分子链,结合单体间可能发生的反应机理,找出高分子链中的链节.凡链节中主碳链为8个碳原子,含有一个碳碳双键结构时,其单体可为一种二烯烃,两种单烯烃.含有二个碳碳双键时,其单体可为二烯烃等.
解答 解:分析其链节可知,链节中主碳链为8个碳原子,含有一个碳碳双键结构时,其单体为一种二烯烃,两种单烯烃.
按如图方式断键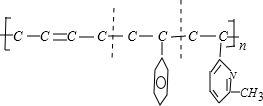 ,可得其单体为
,可得其单体为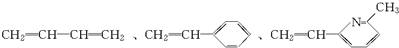 .尤其是找第3种单体时,注意-CH3与-CH═CH2在环上相对“N”的位置.即单体为②③⑤
.尤其是找第3种单体时,注意-CH3与-CH═CH2在环上相对“N”的位置.即单体为②③⑤
故选B.
点评 本题主要考查对高分子化合物的理解,难度中等,注意-CH3与-CH═CH2在环上相对“N”的位置,为易错点.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
4.4月25日,尼泊尔发生8.1级地震,受灾地区震后急需从外地补充大量物资.下列物质是救灾物资的一部分,相关说法不正确的是( )
| A. | 葡萄糖氯化钠注射液--用于补充热能和体液 | |
| B. | 二氧氯(ClO2)或漂白粉--利用其氧化性对居所和饮用水消毒 | |
| C. | 络合碘--碘化钾的水溶液,可以用于皮肤和粘膜的消毒 | |
| D. | 电池--通常选用干电池,用于小功率电器的供电 |
5.某溶液X可能含有K+、Fe2+、Fe3+、CO32-、NO3-、SO42-中的一种或几种,现每次取该溶液100mL分别进行如下实验,下列判断不正确的是( )


| A. | 溶液中一定不存在CO32- | B. | 溶液中一定不存在Fe3+ | ||
| C. | 溶液中一定存在K+ | D. | 溶液中c(NO3-)=0.1mol/L |
17.运用元素周期表的变化规律,推断下列说法不正确的是( )
| A. | 铍是一种轻金属,它的氧化物对应水化物可能是两性 | |
| B. | 砹是一种有色固体,它的气态氢化物很不稳定,砹化银是有色不溶于稀HNO3的沉淀 | |
| C. | 硫酸锶难溶于水和稀HNO3,其氢氧化物为强碱 | |
| D. | 硒化氢是无色无味气体,没有H2S稳定 |
4.下列化学方程式不正确的是( )
| A. | 乙醇与浓氢溴酸反应:CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热:CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr | |
| C. | 苯酚钠中通入二氧化碳:2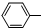 ONa+CO2+H2O→2 ONa+CO2+H2O→2 OH+Na2CO3 OH+Na2CO3 | |
| D. | 淀粉在稀硫酸作用下水解:(C6H10O5)n(淀粉)+nH2O$→_{△}^{稀硫酸}$nC6H12O6 |
18.将0.2mol两种气态烃组成的混合气体完全燃烧后得到(标准状况下)6.72L二氧化碳和7.2g水,下列说法正确的是( )
| A. | 一定有乙烯 | B. | 可能有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
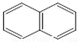 或
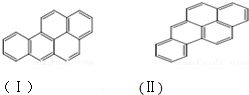
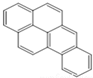
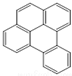
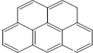
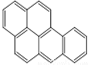
或 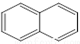 ,两者是等同的.苯并[α]芘是强致癌物质(存在于烟囱灰、煤焦油、燃烧的烟雾和内燃机的尾气中).它的分子由5个苯环并合而成,其结构可以表示为(Ⅰ)或(Ⅱ)式,这两者也是等同的:
,两者是等同的.苯并[α]芘是强致癌物质(存在于烟囱灰、煤焦油、燃烧的烟雾和内燃机的尾气中).它的分子由5个苯环并合而成,其结构可以表示为(Ⅰ)或(Ⅱ)式,这两者也是等同的: