题目内容
12.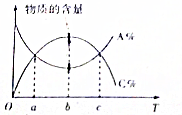 对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )
对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )| A. | 该反应为吸热反应 | |
| B. | 在a,c时刻,正逆反应速率相等 | |
| C. | 若横轴为压强,则存在m+n<p | |
| D. | b时刻正逆反应速率大于c时刻的正逆反应速率 |
分析 温度b之前,A的含量降低、C的含量升高,温度b时A的含量最低、C的含量最高,温度b之后,A的含量由升高、C的含量开始降低,说明温度0~b之间,反应未达到平衡,反应向正反应进行,温度b时达到平衡,温度高于b,平衡向逆反应进行,说明正反应为放热反应,且曲线各点均为平衡状态.
若横轴为压强,说明增大压强平衡向逆反应方向移动,即逆反应为气体体积减小的反应,C一定为气体,A、B状态不同确定,m+n与p的关系与A、B状态有关.
解答 解:温度b之前,A的含量降低、C的含量升高,温度b时A的含量最低、C的含量最高,温度b之后,A的含量由升高、C的含量开始降低,说明温度0~b之间,反应未达到平衡,反应向正反应进行,温度b时达到平衡,温度高于b,平衡向逆反应进行,说明正反应为放热反应,且曲线各点均为平衡状态.
A.由上述分析可知,该反应为放热反应,故A错误;
B.由上述分析可知,c时处于平衡状态,正逆反应速率相等,但a时没有得到平衡状态,反应向正反应进行,则a时正反应速率大于逆反应速率,故B错误;
C.若横轴为压强,说明增大压强平衡向逆反应方向移动,即逆反应为气体体积减小的反应,C一定为气体,若A、B均为气态,则m+n<p,故C正确;
D.温度b时,处于平衡状态,温度c升高温度到达平衡,新平衡的速率高于原平衡,故D错误,
故选:C.
点评 本题考查物质含量随温度变化关系、化学平衡的影响因素,关键是分析判断温度b及温度高于b时处于平衡状态,侧重考查学生的分析解决问题的能力,难度中等.

练习册系列答案
相关题目
3.常温下,下列表述正确的是( )
| A. | pH=2的CH3COOH溶液的浓度小于pH=2的盐酸的浓度 | |
| B. | 向NaHC03溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO-)增 大 | |
| C. | Na2C03溶液中:即c(Na+)>C(CO32-)>C(OH-)=C(HCO3-)>C(H+) | |
| D. | 将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:C(Na+)+c(H+)=C(CH3COO-)+C(OH-) |
20.2011年3月11日在日本发生的大地震中,福岛核电站发生了核泄漏,其周边区域的空气中漂浮着放射性物质,对环境造成了极大的影响.其中含有碘的同位素${\;}_{53}^{131}$I,${\;}_{53}^{131}$I中的中子数是( )
| A. | 53 | B. | 78 | C. | 131 | D. | 184 |
1.X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是( )

| A. | 若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2 | |
| B. | 若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3 | |
| C. | 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2 | |
| D. | 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3 |
2.下列条件下可能大量共存的离子组是( )
| A. | 某无色溶液中:NH4+、Na+、Cl-、Cr2O72- | |
| B. | 在c(H+)=1×10-13mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| C. | 在pH=1的溶液中:K+、Mg2+、SiO32-、SO42- | |
| D. | 常温下由水电离出的c(H+)=1×10-13mol•L-1的溶液中:Na+、K+、SO32-、CO32- |

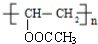 +n NaOH→
+n NaOH→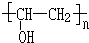 +n CH3COONa.
+n CH3COONa.