题目内容
20.2011年3月11日在日本发生的大地震中,福岛核电站发生了核泄漏,其周边区域的空气中漂浮着放射性物质,对环境造成了极大的影响.其中含有碘的同位素${\;}_{53}^{131}$I,${\;}_{53}^{131}$I中的中子数是( )| A. | 53 | B. | 78 | C. | 131 | D. | 184 |
分析 中子数=质量数-质子数.
解答 解:53131I的质量数为131,质子数为53,则中子数为131-53=78,
故选B.
点评 本题考查中子数、质量数、质子数之间的数量关系,难度不大,学习中注意相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.相同质量的下列各组混合气体完全燃烧,比等质量的乙烯耗氧量多的是( )
| A. | 甲烷和丙烯 | B. | 丙烯和丁烯 | C. | 环丙烷与丙烯 | D. | 丙烯与丙炔 |
11.下列实验操作与预期实验目的或所得实验结论都正确的是( )
| 编号 | 实验操作 | 实验目的或结论 |
| A | 向某有机物中加入新制Cu(OH)2悬浊液并加热,有砖红色沉淀 | 该有机物一定是醛 |
| B | 将CH3CH2Br与NaOH溶液混合加热,再滴加AgNO3溶液,未产生浅黄色沉淀 | 证明CH3CH2Br未发生水解 |
| C | 分别给乙醇和苯酚溶液中加入紫色石蕊试液,观察其颜色的变化 | 比较乙醇和苯酚的酸性强弱 |
| D | 用pH试纸测定CH3COONa溶液的pH | 证明CH3COOH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
8.用NA表示阿伏加德罗常数.下列说法中,正确的是( )
| A. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 2.0g重水(2H2O)中含有的质子数为1.0 NA | |
| C. | 标准状况下,11.2 LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA | |
| D. | 标准状况下,2.24LSO3中含有的O原子的数目为0.3NA |
15. 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
Ⅱ.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ/mol.
(2)2NH3(g)?N2(g)+3H2(g)在恒容密闭容器中达到平衡的标志有:C.
①单位时间内生成3n mol H2同时生成2n mol NH3
②用NH3、N2、H2表示反应速率比为2:1:3
③混合气体的密度不再改变
④混合气体压强不再改变
⑤混合气体平均相对分子质量不再改变
A.①③④B.①②④⑤C.①④⑤D.②③④
(3)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
①20min时,υ正(CO2 )>80min时υ逆(H2O)(填“>”、“=”或“<”).
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为76.53(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象.保持其它条件不变,则(t+10)℃下正确的图象可能是B(填图甲中的“A”或“B”).
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
Ⅱ.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ/mol.
(2)2NH3(g)?N2(g)+3H2(g)在恒容密闭容器中达到平衡的标志有:C.
①单位时间内生成3n mol H2同时生成2n mol NH3
②用NH3、N2、H2表示反应速率比为2:1:3
③混合气体的密度不再改变
④混合气体压强不再改变
⑤混合气体平均相对分子质量不再改变
A.①③④B.①②④⑤C.①④⑤D.②③④
(3)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为76.53(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象.保持其它条件不变,则(t+10)℃下正确的图象可能是B(填图甲中的“A”或“B”).
5.FeCl3溶液和Fe(OH)3胶体共同具备的特性是( )
| A. | 分散质粒子的直径小于1nm | B. | 都是红褐色 | ||
| C. | 都有丁达尔效应 | D. | 都比较稳定 |
12.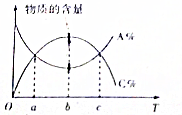 对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )
对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )
 对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )
对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )| A. | 该反应为吸热反应 | |
| B. | 在a,c时刻,正逆反应速率相等 | |
| C. | 若横轴为压强,则存在m+n<p | |
| D. | b时刻正逆反应速率大于c时刻的正逆反应速率 |
9.为实现下列实验目的,如表提供的主要仪器以及所用试剂均合理的是( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 配制480mL 2mol/L的NaOH溶液 | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
| B | 测定中和热 | 烧杯、玻璃棒、纸板、保温塑料、温度计 | 50mL0.5mol/LNaOH溶液与50mL0.5mol/L盐酸 |
| C | 测定生成H2速率 | 分液漏斗、锥形瓶、针筒、铁架台 | Zn粒、稀硫酸 |
| D | 浓硫酸脱水性 | 分液漏斗、试管 | 蔗糖 |
| A. | A | B. | B | C. | C | D. | D |
10.常温离子液体也称常温熔融盐,硝酸乙基铵[(C2H5NH3)NO3]是人类发现的第一种常温离子液体,其熔点为12℃.已知C2H5NH2的化学性质与NH3相似,C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是( )
| A. | 硝酸乙基铵水溶液呈碱性 | |
| B. | 该离子液体可以作为电池的电解质 | |
| C. | (C2H5NH3)NO3能与氢氧化钠反应产生NH3 | |
| D. | 相同温度下,相同物质的量的浓度的硝酸乙基铵溶液和硝酸铵溶液相比前者的pH小 |