题目内容
19.已知元素Se位于第四周期VIA族,下列说法不正确的是( )| A. | 单质Se在空气中燃烧可生成SeO2 | B. | Se的原子序数为24 | ||
| C. | 可形成Na2SeO3、Na2SeO4两种盐 | D. | H2S比H2Se稳定 |
分析 硒为第四周期VIA族元素,与S元素在周期表同一主族,与S元素的性质相似,根据元素周期律的递变规律解答该题.
解答 解:A.单质S在空气中燃烧可生成SO2,Se的性质与S相似,则单质Se在空气中燃烧可生成SeO2,故A正确;
B.Se与S原子序数相差18,S为16,则Se的原子序数为34,故B错误;
C.Se与S元素在周期表同一主族,常见化合价有+4、+6,则可形成Na2SeO3、Na2SeO4两种盐,故C正确;
D.同主族元素从上到下元素的非金属性逐渐减弱,对应氢化物的稳定性逐渐减弱,则稳定性:H2Se<H2S,故D正确.
故选B.
点评 本题考查元素在周期表中的位置以及性质的递变规律,题目难度不大,注意同主族元素性质的相似性和递变性.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 若某温度下,0.2 mol/L的醋酸与0.09 mol/L的氢氧化钡等体积混合后呈中性(不考虑混合后溶液体积的变化),则可算出该温度下醋酸的电离常数 K=9×10-7 mol/L | |
| B. | 若某温度下氯化银的Ksp=10-10mol2/L2,则100 mL0.2 mol/L的氯化钠溶液与0.18 mol/L硝酸银溶液等体积混合后(不考虑混合后溶液体积的变化),溶液中c(Ag+)为10-8 mol/L | |
| C. | 若某温度下1 L密闭容器中反应HCHO(g)十H2(g)?CH3OH(g)达到平衡后甲醛的转化率为50%,则该温度下该反应的平衡常数是2(mol/L)-1 | |
| D. | 若向氢氧化钙的饱和溶液中加人氢氧化钠溶液,则会有固体析出 |
10.下列措施能减慢化学反应速率的是( )
| A. | 双氧水分解时加入二氧化锰 | B. | 将块状药品研细后在进行反应 | ||
| C. | 用较浓的盐酸代替稀盐酸与锌反应 | D. | 将易腐败的食物储存在冰箱里 |
7.在研究有机历程时,常用816O作为示踪原子.816O的原子核内中子数是( )
| A. | 8 | B. | 18 | C. | 10 | D. | 28 |
14.在如图所示的原电池中,下列说法正确的是( )
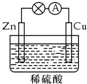

| A. | 负极发生还原反应 | B. | 正极反应为 Cu-2e-═Cu2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 反应一段时间后,溶液的酸性减弱 |
4.W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中 的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体.已知反应:甲+乙→丁+己,甲+丙→戊+己.又知常温下0.01mol•L-1丁溶液的pH为12.下列说法正确的是( )
| A. | 元素X在周期表中的位置为第2周期VIA族 | |
| B. | 1 mol甲与足量的乙完全反应转移的电子数为6.02×1023 | |
| C. | 元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(x) | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子的总物质的量小于0.1 mol |
11.下列有关溶液的说法正确的是( )
| A. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl 溶液、④(NH4)2Fe(SO4)2溶液中,c(${NH}_{4}^{+}$)的大小关系:④>①>②>③ | |
| C. | 将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-) | |
| D. | 物质的量浓度之比为1:1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(${HCO}_{3}^{-}$)+c(${CO}_{3}^{2-}$) |
9.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是( )
| A. | NaOH | B. | KMnO4 | C. | KSCN | D. | 苯酚 |
 CH3COOCH3+H2O.
CH3COOCH3+H2O.