题目内容
【题目】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究:
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下_______(填“能”或“不能”)自发进行。
H2(g) + CO(g) △H=+131.3kJ/mol,△S=+133.7J/(mol·K),该反应在低温下_______(填“能”或“不能”)自发进行。
(2)已知在 400℃时,N2(g) + 3H2(g) ![]() 2NH3(g)的 K=0.5
2NH3(g)的 K=0.5
①在400℃时,2NH3(g)![]() N2(g) + 3H2(g)的 K'=_________(填数值)。
N2(g) + 3H2(g)的 K'=_________(填数值)。
②400℃时,在 0.5L 的反应容器中进行合成氨反应,一段时间后,测得 N2、H2、NH3 的物质的量分别为 2mol、1mol、2mol,则此时反应 v(N2)正_____________ v(N2)逆(填 “>”、“<”、“=”或“不能确定”)。
③已 知 H—H 键 键 能 为 436kJ/mol , N—H 键 键 能 为 391kJ/mol , N N 键 键 能 为945.6kJ/mol,则反应N2(g)+ 3H2(g)![]() 2NH3(g)的△H= ____________。若在恒温、恒压条件下,向平衡体系中通入氩气,则平衡_____________(填“向左”、 “向右”或“不”)移动;使用催化剂_____________(填“增大”、“减小”或“不改变”)反 应的△H。
2NH3(g)的△H= ____________。若在恒温、恒压条件下,向平衡体系中通入氩气,则平衡_____________(填“向左”、 “向右”或“不”)移动;使用催化剂_____________(填“增大”、“减小”或“不改变”)反 应的△H。
(3)在 25℃下,将 a mol/L 的氨水和 0.01mol/L 的盐酸等体积混合,反应平衡时溶液中的 c(NH4+)=c(Cl-),则溶液显__________(填“酸”、“碱”或“中”)性;用含 a 的代数式表示 NH3H2O 电离常数 Kb= ______________________________________。
【答案】不能 2 = ![]() 向左 不改变 中
向左 不改变 中 ![]()
【解析】
(1)![]() ,在低温时该值大于0,所以不能在低温下自发进行,答案为:不能;
,在低温时该值大于0,所以不能在低温下自发进行,答案为:不能;
(2)N2(g) + 3H2(g)![]() 2NH3(g)与2NH3(g)
2NH3(g)与2NH3(g)![]() N2(g) + 3H2(g)互为可逆反应,平衡常数互为倒数,K'=2;一段时间后,测得N2、H2、NH3 的物质的量浓度分别为4 mol/L,2mol/L,4mol/L,
N2(g) + 3H2(g)互为可逆反应,平衡常数互为倒数,K'=2;一段时间后,测得N2、H2、NH3 的物质的量浓度分别为4 mol/L,2mol/L,4mol/L,![]() ,所以该状态是平衡状态,正逆反应速率相等;根据键能大小直接计算反应焓变
,所以该状态是平衡状态,正逆反应速率相等;根据键能大小直接计算反应焓变![]() ;在恒温、恒压条件下,向平衡体系中通入氩气,体积增大,相当于压强减小,平衡向气体分子数增大的方向移动,向左移动;催化剂不改变反应的焓变;答案为:2;=;
;在恒温、恒压条件下,向平衡体系中通入氩气,体积增大,相当于压强减小,平衡向气体分子数增大的方向移动,向左移动;催化剂不改变反应的焓变;答案为:2;=;![]() ;向左;不改变;
;向左;不改变;
(3)根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),已知c(NH4+)=c(Cl-),所以c(H+)=c(OH-),显中性;此溶液中,c(NH4+)=c(Cl-)=0.005 mol/L,c(H+)=c(OH-)=![]() ;
;![]() ;NH3H2O电离常数
;NH3H2O电离常数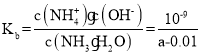 ;答案为:中;
;答案为:中;![]() 。
。