题目内容
【题目】2018年11月《Nature Energy》报道了巾科院大连化学物理研究所科学家用Ni- BaH2 /Al2O3、Ni- LiH等作催化剂,实现了在常压、100-300℃的条件下合成氨。
(1)在元素周期表中,氧和与其相邻且同周期的两种元素的第一电离能由大到小的顺序为 __ ;基态Ni2+的核外电子排布式为 ___,若该离子核外电子空间运动状态有15种,则该离子处于 ___(填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中NO3的空间构型为____。
②甘氨酸中N原子的杂化类型为____,分子中σ键与π键的个数比为____,晶体类型是 ___,其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-2l℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是____。
(3)NH3分子中的键角为107°,但在[Cu(NH3)4]2+离子中NH3分子的键角如图l所示,导致这种变化的原因是____

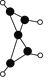
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为d pm,密度为ρg/cm3,则阿伏加德罗常数NA=____(列出表达式)mol-l。
【答案】F>N>O 1s22s22p63s23p63d8或[Ar] 3d8 激发 平面三角形 sp3 9:1 分子晶体 分子数相同时,甘氨酸分子间形成的氢键数目比丙酸分子间形成的氢键数目多(或甘氨酸中氨基的存在也会使分子间产生氢键) 形成配合离子后,配位键与NH3中N—H键之间的排斥力小于原孤对电子与NH3中N—H键之间的排斥力,故配合离子中NH3的N—H键间的键角变大; ![]()
【解析】
(1)与氧相邻且同周期的元素为N和F,由于N原子最外层电子为半充满状态,第一电离能较大,所以三者第一电离能由大到小的顺序为F>N>O;Ni元素为28号元素,失去最外层两个电子形成Ni2+,基态Ni2+的核外电子排布式为1s22s22p63s23p63d8或[Ar] 3d8;基态Ni2+的核外电子空间运动状态有1+1+3+1+3+5=14种,若该离子核外电子空间运动状态有15种,则该离子处于激发态;
(2)①NO3的中心原子价层电子对数为![]() =3,孤电子对数为0,所以空间构型为平面三角形;
=3,孤电子对数为0,所以空间构型为平面三角形;
②甘氨酸(NH2CH2COOH)中N原子形成两个N-H键和一个N-C键,达到饱和状态,价层电子对数为4,所以为sp3杂化;分子中碳氧双键中存在一个π键,其余共价键均为σ键,所以分子中σ键与π键的个数比为9:1;甘氨酸熔沸点较低属于分子晶体;分子数相同时,甘氨酸分子间形成的氢键数目比丙酸分子间形成的氢键数目多(或甘氨酸中氨基的存在也会使分子间产生氢键);
(3)形成配合离子后,配位键与NH3中N—H键之间的排斥力小于原孤对电子与NH3中N—H键之间的排斥力,故配合离子中NH3的N—H键间的键角变大;
(4)根据均摊法,该晶胞中Li原子个数为8,其分子式为Li2NH,则晶胞中NH原子团的个数为4,则晶胞的质量为m=![]() g,晶胞参数为d pm=d×10-10cm,所以晶胞的体积V=d3×10-30cm3,则密度
g,晶胞参数为d pm=d×10-10cm,所以晶胞的体积V=d3×10-30cm3,则密度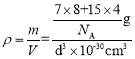 ,解得NA=
,解得NA=![]() 。
。