题目内容
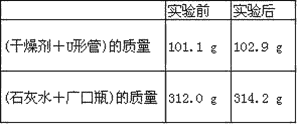
【题目】(1)在1800K时,2Fe(s)+3/2O2(g)=Fe2O3(s) H= -354.2kJ/mol;
3Fe(s)+2O2(g)=Fe3O4(s) H= -550.9kJ/mol
则反应:2Fe3O4(s)+1/2O2(g) === 3Fe2O3(s)的H =_____ kJ·mol1,四氧化三铁在充满氧气的集气瓶中反应生成Fe2O3_____(填“能”或“不能”)自发进行。
(2)2018年是合成氨工业先驱哈伯(PHaber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) ![]() NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*![]() NH*;NH*+ H*
NH*;NH*+ H*![]() NH2*;NH2* + H*
NH2*;NH2* + H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答:
①利于提高合成氨平衡产率的条件有__________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
②实际生产中,常用Fe作催化剂,控制温度773K,压强3.0 ×105Pa,原料中N2和H2物质的量之比为1:2.8。
分析说明原料气中N2过量的两个理由_________;_____________。
③关于合成氨工艺的下列理解,正确的是_______。
A.合成氨反应在不同温度下的△H和△S都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发
【答案】+39.2 不能 AD 原料气中N2相对易得,适度过量有利于提高H2的转化率 N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率 ACD
【解析】
(1)依据盖斯定律计算反应H;依据H—TS判断反应能否自发进行;
(2)①合成氨反应为气体体积减小的放热反应;
②加过量氮气,平衡正向移动;N2在Fe催化剂上的吸附是决速步骤;
③A、合成氨反应为气体体积减小的放热反应;
B、恒压条件充入少量惰性气体,相当于减压;
C、不断将氨气液化,生成物浓度降低;
D、CH4、CO等易燃易爆气体,可能会与催化剂反应。
(1)将已知反应依次编号,由盖斯定律①×3—②×2得2Fe3O4(s)+1/2O2(g) === 3Fe2O3(s),则H=(-354.2kJ/mol)×3—(-550.9kJ/mol)×2=+39.2 kJ/mol;因该反应H>0,S<0,则H—TS>0,该反应不能自发进行,故答案为:+39.2;不能;
(2)①合成氨反应为气体体积减小的放热反应,由勒夏特列原理可知,低温和高压,平衡正向移动,有利于提高合成氨平衡产率,故答案为:AD;
②加过量氮气,平衡正向移动,有利于提高H2的转化率以及氨气的产率;根据题干“N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率”可知,N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率,故答案为:原料气中N2相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率;
③A、合成氨反应为气体体积减小的放热反应,在不同温度下H<0,S<0,正确;
B、恒压条件充入少量惰性气体,相当于减压,平衡逆向移动,不利于提高平衡转化率,错误;
C、不断将氨气液化,生成物浓度降低,有利于平衡正向移动,正确;
D、通过天然气和水蒸气转化制得的H2,由于含有CH4、CO等易燃易爆气体,容易出现安全隐患,此外CH4、CO可能会与催化剂反应,造成催化剂活性降低,所以必须经过净化处理,正确;
故选ACD,故答案为:ACD。

【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变