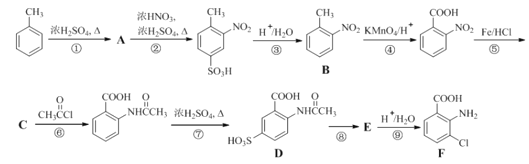
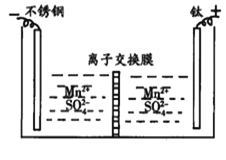
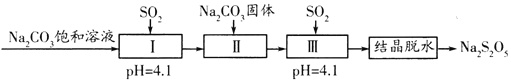
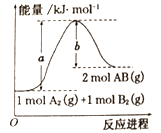
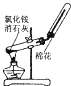
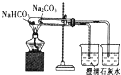
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ‘Ύ10 LΚψ»ίΟή±’»ίΤς÷–≥δ»κX(g)ΚΆY(g)Θ§ΖΔ…ζΖ¥”ΠX(g)ΘΪY(g) ![]() M(g)ΘΪN(g)Θ§ΥυΒΟ Β―ι ΐΨί»γœ¬±μΘΚ
M(g)ΘΪN(g)Θ§ΥυΒΟ Β―ι ΐΨί»γœ¬±μΘΚ
Β―ι ±ύΚ≈ | Έ¬Ε»/Γφ | Τπ Φ ±Έο÷ ΒΡΝΩ/mol | ΤΫΚβ ±Έο÷ ΒΡΝΩ/mol | |
n(X) | n(Y) | n(M) | ||
ΔΌ | 700 | 0.10 | 0.40 | 0.090 |
ΔΎ | 800 | 0.10 | 0.40 | 0.080 |
Δέ | 800 | 0.20 | 0.30 | a |
Δή | 900 | 0.10 | 0.15 | b |
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «( )
A.ΗυΨί Β―ιΔΌΓΔΔΎΩ…“‘ΆΤ≤βΗΟΖ¥”Π’ΐΖ¥”ΠΓςH>0
B. Β―ιΔΎ÷–Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐKΘΫ2.0
C. Β―ιΔέ÷–Θ§¥οΒΫΤΫΚβ ±Θ§XΒΡΉΣΜ·¬ ΈΣ60%
D. Β―ιΔή÷–Θ§¥οΒΫΤΫΚβ ±Θ§b>0.060
ΓΨ¥πΑΗΓΩC
ΓΨΫβΈωΓΩ
AΘ°Ζ÷ΈωΔΌΔΎ÷–¥οΤΫΚβ ±ΤΫΚβ≥Θ ΐΒΡ±δΜ·Θ§άϊ”Οά’œΡΧΊΝ–‘≠άμΩ…“‘ΒΟ÷ΣΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘΜ
BΘ°”…±μ÷– ΐΨίΘ§άϊ”Ο»ΐΕΈ ΫΦΤΥψΤΫΚβ ±ΤδΥϋΉιΖ÷ΒΡΈο÷ ΒΡΝΩΘ§”…”ΎΖ¥”Π÷–ΤχΧεΒΡΜ·―ßΦΤΝΩ ΐœύΒ»Θ§Ω…“‘”ΟΈο÷ ΒΡΝΩ¥ζΧφ≈®Ε»¥ζ»κΤΫΚβ≥Θ ΐ±μ¥ο ΫΦΤΥψΘΜ
CΘ°Έ¬Ε»≤Μ±δΤΫΚβ≥Θ ΐ≤Μ±δΘ§ΗυΨίΤΫΚβ≥Θ ΐΩ…«σ≥ωΉΣΜ·ΝΩΘ§ΫχΕχ«σ≥ωΉΣΜ·¬ ΘΜ
DΘ°Ε‘±» Β―ιΔΌΔΎΒΡΤΫΚβ≥Θ ΐΩ…÷ΣΘ§’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ§…ΐΈ¬ΤΫΚβΉσ“ΤΘ§ΤΫΚβ≥Θ ΐΦθΘ§ΉΣΜ·¬ Φθ–ΓΘ§ΗυΨί Β―ιΔέ÷–XΒΡΉΣΜ·¬ ΈΣ60%Θ§‘ρ Β―ιΔή4÷–XΒΡΉΣΜ·¬ –Γ”Ύ60%Θ§¥οΒΫΤΫΚβ ±Θ§b<0.060ΘΜ
X(g)ΘΪY(g)M(g)ΘΪN(g)
Τπ Φ≈®Ε»Θ®mol/LΘ©0.010.04 00
ΉΣΜ·≈®Ε»Θ®mol/LΘ©0.009 0.0090.009 0.009
ΤΫΚβ≈®Ε»Θ®mol/LΘ©0.0010.031 0.009 0.009
Β―ιΔΌ÷–Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK= ![]() =
=![]() =2.61ΘΜ
=2.61ΘΜ
X(g)ΘΪY(g)M(g)ΘΪN(g)Θ§
Τπ Φ≈®Ε»Θ®mol/LΘ©0.010.04 00
ΉΣΜ·≈®Ε»Θ®mol/LΘ©0.008 0.0080.008 0.008
ΤΫΚβ≈®Ε»Θ®mol/LΘ©0.0020.032 0.008 0.008
Β―ιΔΎ÷–Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK= ![]() =
=![]() =1.0
=1.0
AΘ°”…ΔΌΩ…÷Σ700Γφ ±Θ§Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣ2.61Θ§”…ΔΎΩ…÷Σ800ΓφΖ¥”Π¥οΤΫΚβ ±ΤΫΚβ≥Θ ΐΈΣ1.0Θ§Φ¥Έ¬Ε»…ΐΗΏΤΫΚβ≥Θ ΐΦθ–ΓΘ§Ω…÷ΣΈ¬Ε»…ΐΗΏΤΫΚβΉσ“ΤΘ§”…Ν–œΡΧΊά’‘≠άμΩ…÷Σ…ΐΈ¬ΤΫΚβœρΈϋ»»ΖΫœρ“ΤΕ·Θ§Ι ΡφΖ¥”ΠΖΫœρΈΣΈϋ»»Ζ¥”ΠΘ§Φ¥ΓςH<0.Ι A¥μΈσΘΜ
BΘ°”…±μΗώΩ…÷Σ¥οΤΫΚβ ±ΗΟΖ¥”Π‘Ύ800Γφ ±ΒΡΤΫΚβ≥Θ ΐΈΣ1.0Θ§Ι Bœν¥μΈσΘΜ
CΘ°”…ΔέΩ…÷ΣΘ§¥οΤΫΚβ ±ΤΫΚβ≥Θ ΐΈΣ1.0Θ§Ι Ω…÷Σ¥οΤΫΚβ ±n(M)=0.12molΘ§![]() n(X)=0.12Θ§Ι XΒΡΉΣΜ·¬ ΈΣ60%ΘΜ
n(X)=0.12Θ§Ι XΒΡΉΣΜ·¬ ΈΣ60%ΘΜ
DΘ°”…±μΗώΩ…÷Σ‘ΎΈ¬Ε»≤Μ±δ ±ΔέΚΆΔήΈΣΒ»–ßΤΫΚβΘ§¥Υ ±b=0.06Θ§ΒΪ «”…ΔΌΚΆΔΎΩ…÷ΣΗΟΖ¥”Π’ΐœρΈΣΖ≈»»Ζ¥”ΠΘ§Έ¬Ε»…ΐΗΏΤΫΚβΉσ“ΤΘ§Ι b<0.060Θ§Dœν¥μΈσΘΜ
Ι ¥πΑΗΈΣCΓΘ

ΓΨΧβΡΩΓΩάϊ”Οœ¬Ν–ΉΑ÷ΟΖ÷±πΆξ≥…œύΙΊ Β―ιΘ§Ρή¥οΒΫ Β―ιΡΩΒΡ «![]()
A | B | C | D |
÷Τ±Η≤Δ ’Φ·Α±Τχ | ±»Ϋœ | ”ΟNaOH»ή“ΚΒΈΕ®ΉΕ–ΈΤΩ÷–ΒΡ―ΈΥα»ή“Κ | ÷Τ±Η““Υα““θΞ |
|
|
|
|
A.AB.BC.CD.D
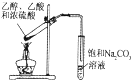
ΓΨΧβΡΩΓΩœ¬Ν–Ϋβ Ά Β―ι ¬ ΒΒΡΜ·―ß”Ο”ο≤Μ’ΐ»ΖΒΡ «Θ® Θ©
Β―ι | Ϋβ Ά | |
A | 25Γφ0.1mol/L―ΈΥα»ή“ΚpH=1 | H2O=H++OH- |
B | 25Γφ0.1mol/LΒΡNH3ΓΛH2OpH=11 | NH3ΓΛH2O |
C | ≈δ÷ΤFeCl3»ή“Κ ±Φ”…ΌΝΩ―ΈΥα | Fe3++3H2O |
D | œρ0.1mol/LNa2CO3»ή“Κ÷–ΒΈΦ”Ζ”ΧΣ ‘“ΚΚσ»ή“Κ±δΚλ | CO32-+H2O |
A.AB.BC.CD.D