题目内容
【题目】工业上电解MnSO4溶液制备Mn和MnO2,工作原理如图所示,下列说法不正确的是
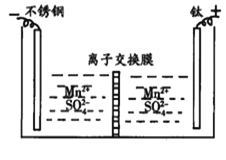
A.阳极区得到H2SO4
B.阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+
C.离子交换膜为阳离子交换膜
D.当电路中有2mole-转移时,生成55gMn
【答案】C
【解析】
根据图示,不锈钢电极为阴极,阴极上发生还原反应,电解质溶液中阳离子得电子,电极反应为:Mn2++2e-= Mn;钛土电极为阳极,锰离子失去电子转化为二氧化锰,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+,据此解题。
A.根据分析,阴极电极反应为:Mn2++2e-= Mn,阳极电极反应为:Mn2+-2e-+2H2O=MnO2+4H+,阴极区的SO42-通过交换膜进入阳极区,因此阳极上有MnO2析出,阳极区得到H2SO4,故A正确;
B.根据分析,阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+,故B正确;
C.由A项分析,阴极区的SO42-通过交换膜进入阳极区,则离子交换膜为阴离子交换膜,故C错误;
D.阴极电极反应为:Mn2++2e-= Mn,当电路中有2mole-转移时,阴极生成1mol Mn,其质量为1mol ×55g/mol=55g,故D正确;
答案选C。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】已知反应:2HBr(g)![]() Br2(g)+H2(g),在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:
Br2(g)+H2(g),在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验序号 | 实验温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.63 | 0.60 | 0.60 | 0.60 | |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
下列说法正确的是( )
A.从上表数据分析,2HBr(g)![]() Br2(g)+H2(g)正反应为放热反应
Br2(g)+H2(g)正反应为放热反应
B.实验2中HBr的初始浓度C2=1.0 mol/L
C.实验3反应速率小于实验1的反应速率
D.实验4一定使用了催化剂
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.40 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是( )
A.根据实验①、②可以推测该反应正反应△H>0
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060