题目内容
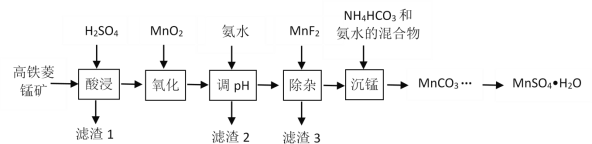
【题目】一水硫酸锰(MnSO4H2O)是一种重要的化工中间体,工业上可由高铁菱锰矿(主要成分为MnCO3,含有FeCO3、Al2O3、MgO、CaO、SiO2等杂质)制备,部分工艺流程如下:
相关金属离子[c(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的 pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“酸浸”时高铁菱锰矿需要粉碎,并进行充分搅拌,为提高锰的浸出率还可采取的措施有_________。(写出其中一种)
(2)“氧化”时发生反应的化学方程式为________。
(3)“调pH”范围至5~6,得到滤渣2的主要成分除MnO2外还有_________。
(4)“除杂”过程中加入MnF2的目的是_________。已知:Ksp(MgF2)=5.16×10-11,Ksp(CaF2)=5.3×10-9。
(5)“沉锰”过程中发生反应的离子方程式为_________。
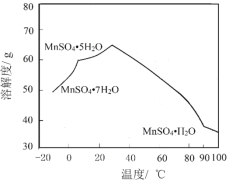
(6)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4H2O 晶体的方法是:将MnCO3溶于_________,控制温度为_________以上结晶,得到MnSO4H2O晶体,洗涤、烘干。晶体烘干时温度不能过高的原因是_________。
【答案】升高温度或适当增大硫酸浓度 2FeSO4 + MnO2 + 2H2SO4= Fe2(SO4)3 + MnSO4 + 2H2O Al(OH)3、Fe(OH)3 除去Ca2+ 和Mg2+ Mn2+ + HCO![]() + NH3H2O = MnCO3↓ + NH4+ + H2O 适量的稀硫酸 90℃ 防止MnSO4H2O失去结晶水
+ NH3H2O = MnCO3↓ + NH4+ + H2O 适量的稀硫酸 90℃ 防止MnSO4H2O失去结晶水
【解析】
(1)“酸浸”时高铁菱锰矿需要粉碎,并进行充分搅拌,为提高锰的浸出率,还可采取的措施有升高温度或适当增大硫酸浓度。答案为:升高温度或适当增大硫酸浓度
(2)“氧化”时,主要是利用MnO2将Fe2+氧化为Fe3+,发生反应的化学方程式为2FeSO4 + MnO2 + 2H2SO4= Fe2(SO4)3 + MnSO4 + 2H2O。
答案为:2FeSO4 + MnO2 + 2H2SO4= Fe2(SO4)3 + MnSO4 + 2H2O
(3)查表中数据知,“调pH”范围至5~6,可将Fe3+、Al3+转化为沉淀。得到滤渣2的主要成分除MnO2外还有Al(OH)3、Fe(OH)3。答案为:Al(OH)3、Fe(OH)3
(4)此时溶液中还存在Mg2+、Ca2+ 两种杂质离子,后续操作中没有除杂质的操作,所以“除杂”过程中加入MnF2的目的是除去Ca2+ 和Mg2+。答案为:除去Ca2+ 和Mg2+
(5)“沉锰”过程中,加入NH4HCO3和氨水,目的是将Mn2+转化为MnCO3沉淀,发生反应的离子方程式为Mn2+ + HCO![]() + NH3H2O = MnCO3↓ + NH4+ + H2O。
+ NH3H2O = MnCO3↓ + NH4+ + H2O。
答案为:Mn2+ + HCO![]() + NH3H2O = MnCO3↓ + NH4+ + H2O
+ NH3H2O = MnCO3↓ + NH4+ + H2O
(6)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4H2O晶体的方法是:因为要将MnCO3转化为MnSO4,所以应溶于适量的稀硫酸。
答案为:适量的稀硫酸
为降低MnSO4的溶解度,参照表中数据,需控制温度为90℃以上结晶。答案为:90℃
得到MnSO4H2O晶体,洗涤、烘干。
因为晶体受热易失去结晶水,所以晶体烘干时温度不能过高,其原因是防止MnSO4H2O失去结晶水。答案为:防止MnSO4H2O失去结晶水

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案