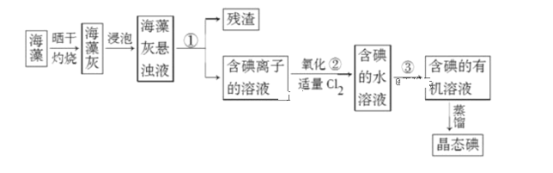
题目内容
【题目】下列说法中正确的是( )
A. 已知2CO(g)+O2(g)=2CO2(g) △H= -566.0kJmol﹣1则该反应的反应热为566.0kJmol-1
B. 甲烷的燃烧热△H= -890kJmol-1,则甲烷燃烧的热化学方程式为CH4(g)+O2(g)=CO2(g)+2H2O(g) △H= -890kJmol-1
C. 在一定条件下将1mol SO2和0.5mol O2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) △H= -158.4kJmol-1
2SO3(g) △H= -158.4kJmol-1
D. 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H= -57.3kJmol-1,但稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量小于57.3kJ
【答案】D
【解析】
A、反应热是有符号的,即该反应的反应热为-566.0kJ·mol-1,故A错误;
B、甲烷的燃烧热,即1mol甲烷燃烧生成CO2和液态水,题中所给反应中的水为气态,即△H>-890kJ·mol-1,故B错误;
C、SO2和氧气反应是可逆反应,本题没有说明有多少SO2或O2消耗,或者是SO3的生成,因此无法计算出该反应的△H,故C错误;
D、醋酸为弱酸,其电离是吸热过程,因此稀醋酸与稀氢氧化钠反应生成1mol水时放出的热量小于57.3kJ,故D正确;
答案选D。

【题目】一水硫酸锰(MnSO4H2O)是一种重要的化工中间体,工业上可由高铁菱锰矿(主要成分为MnCO3,含有FeCO3、Al2O3、MgO、CaO、SiO2等杂质)制备,部分工艺流程如下:
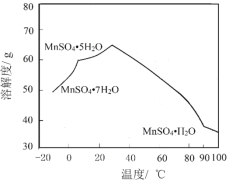
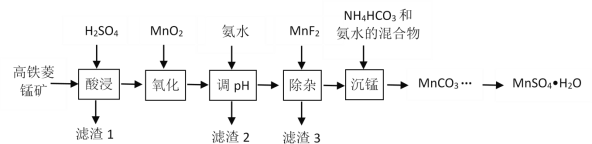
相关金属离子[c(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的 pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“酸浸”时高铁菱锰矿需要粉碎,并进行充分搅拌,为提高锰的浸出率还可采取的措施有_________。(写出其中一种)
(2)“氧化”时发生反应的化学方程式为________。
(3)“调pH”范围至5~6,得到滤渣2的主要成分除MnO2外还有_________。
(4)“除杂”过程中加入MnF2的目的是_________。已知:Ksp(MgF2)=5.16×10-11,Ksp(CaF2)=5.3×10-9。
(5)“沉锰”过程中发生反应的离子方程式为_________。
(6)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4H2O 晶体的方法是:将MnCO3溶于_________,控制温度为_________以上结晶,得到MnSO4H2O晶体,洗涤、烘干。晶体烘干时温度不能过高的原因是_________。