题目内容
【题目】普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是

A. 化学式可以表示为KFe2(CN)6
B. 每一个立方体中平均含有24个π键
C. 普鲁士蓝不属于配位化合物
D. 每个Fe3+周围与之相邻的Fe2+离子有12个
【答案】A
【解析】
A.每隔一个立方体中心有一个钾离子,所以一个晶胞中钾离子个数为0.5,该立方体中铁原子个数=![]() ×8=1,CN-位于每条棱上,该立方体中含有CN-个数=
×8=1,CN-位于每条棱上,该立方体中含有CN-个数=![]() ×12=3,所以平均化学式是K 0.5 Fe(CN)3,化学式可以表示为KFe2(CN)6,故A正确;
×12=3,所以平均化学式是K 0.5 Fe(CN)3,化学式可以表示为KFe2(CN)6,故A正确;
B.每个CN-含有2个π键,每个立方体中含有CN-个数为3,所以一个立方体中含有6个π键,故B错误;
C.普鲁士蓝中Fe3+含有空轨道,CN-中N原子提供孤电子对,形成配位键,属于配合物,故C错误;
D.根据图示,普鲁士蓝中Fe3+周围Fe2+离子个数为6个,故D错误;
答案选A。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
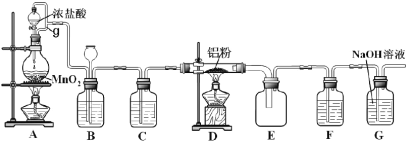
小学教材完全解读系列答案【题目】一水硫酸锰(MnSO4H2O)是一种重要的化工中间体,工业上可由高铁菱锰矿(主要成分为MnCO3,含有FeCO3、Al2O3、MgO、CaO、SiO2等杂质)制备,部分工艺流程如下:
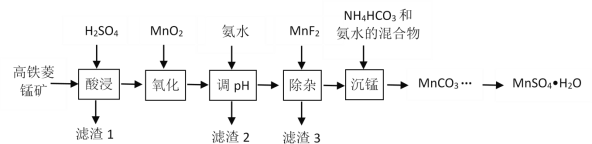
相关金属离子[c(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的 pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“酸浸”时高铁菱锰矿需要粉碎,并进行充分搅拌,为提高锰的浸出率还可采取的措施有_________。(写出其中一种)
(2)“氧化”时发生反应的化学方程式为________。
(3)“调pH”范围至5~6,得到滤渣2的主要成分除MnO2外还有_________。
(4)“除杂”过程中加入MnF2的目的是_________。已知:Ksp(MgF2)=5.16×10-11,Ksp(CaF2)=5.3×10-9。
(5)“沉锰”过程中发生反应的离子方程式为_________。
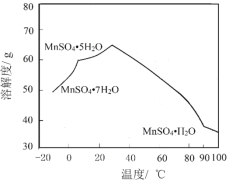
(6)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4H2O 晶体的方法是:将MnCO3溶于_________,控制温度为_________以上结晶,得到MnSO4H2O晶体,洗涤、烘干。晶体烘干时温度不能过高的原因是_________。