题目内容
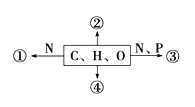
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题.(题中的字母只代表元素代号,与实际元素符号无关):
(1)B的元素符号为_________,E元素在周期表中位于第____周期_____族;
(2)A、C、D三种元素组成的一种常见化合物,是氯碱工业的重要的产品,请写出该反应的化学方程式___________。
(3)A2C和A2E两种物质沸点较高的是_______(填写化学式),原因是:_______。
(4)B与F两种元素形成的一种化合物分子,各原子均达8电子结构,则该化合物化学式为____。B和F两种元素还能形成另一种化合物,其中B显最高正价,该化合物能与水反应生成两种酸,请写出该化合物与水反应的化学方程式:____________。
【答案】 N 3 VIA 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ H2O 水分子之间有氢键 NCl3 NCl5+3H2O=HNO3+5HCl
2NaOH+H2↑+Cl2↑ H2O 水分子之间有氢键 NCl3 NCl5+3H2O=HNO3+5HCl
【解析】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,化合物为水,则A为H元素,C为O元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素;即A为H元素,B为N元素;C为O元素,D为Na元素;E为S元素;F为
Cl元素。
(1) B为N元素,元素符号为N;E为S元素,核电荷数为16,在周期表中位于第3周期 VIA族;正确答案:N ;3; VIA。
(2)H、O、Na三种元素组成的一种常见化合物为氢氧化钠,是氯碱工业的重要的产品,电解饱和食盐水可以的得到氢氧化钠、氯气和氢气,反应的化学方程式2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;正确答案:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;正确答案:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(3)水的沸点大于硫化氢的沸点,因为水分子之间有氢键,硫化氢分子间不存在氢键;正确答案:H2O;水分子之间有氢键。
(4)B为N元素,F为Cl元素;N与Cl两种元素形成的一种化合物分子,各原子均达8电子结构,则该化合物化学式为NCl3;N和Cl两种元素还能形成另一种化合物,其中显N最高正价为+5,该化合物能与水反应生成两种酸,该化合物为NCl5,与水反应生成硝酸和盐酸,反应的化学方程式:NCl5+3H2O=HNO3+5HCl;正确答案:NCl3; NCl5+3H2O=HNO3+5HCl。

【题目】I.近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2 L 密闭容器内,400 ℃时反应:CO(g)+2H(g) ![]() CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
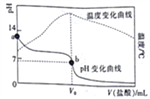
(1)图中表示CH3OH 的变化的曲线是_______。

(2)用H2 表示从0~2s 内该反应的平均速率v(H2)=______。
(3)能说明该反应已达到平衡状态的是______。
a.v(CH3OH)=2v(H2) b.容器内压强保持不变
c.2V 逆(CO)= v 正(H2) d.容器内密度保持不变
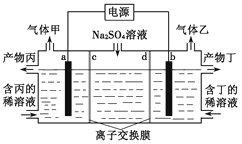
(4) CH3OH 与O2的反应可将化学能转化为电能,其工作原理如右图所示,图中CH3OH 从______(填A 或B)通入, b 极的电极反应式是______。
II.某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①: 把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②: 把纯锌片投入到含FeCl3 的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③: 在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是_______________。 t2~t3速率变化的主要原因是______________。
(2)实验②放出氢气的量减少的原因是________。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?_____ (填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:________________。
b、若正确则写出实验③中原电池的正极电极反应式________________。
【题目】控制“酸雨”是防治大气污染的重要问题之一。煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用Ca(ClO)2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)Ca(ClO)2中氯元素的化合价为___________。
(2)工业上制备Ca(ClO)2的化学方程式_________________________________________________。
(3)实验室在鼓泡反应器中通入含有SO2的烟气,反应温度为323 K,Ca(ClO)2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42 | Cl |
c/(mol·L1) | 5×103 | 1×102 |
写出Ca(ClO)2溶液在脱硫过程中主要反应的离子方程式____________________________________。
(4)目前可用电化学方法处理由二氧化硫引起的酸雨。常见的一种方法是惰性电极电解氢溴酸,其阳极的电极反应为:___________________________________。阴极的电极反应为:_________________________________。总反应的化学方程式为:___________________________。
(5)将其阳极产物用水溶解配成溶液去淋洗含二氧化硫的废气。上述吸收废气发生的反应化学方程式为:________________________________________。若反应中转移电子1mol,则可吸收二氧化硫气体体积在标准状况下为_________L。