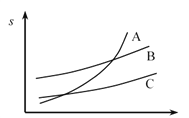
题目内容
【题目】控制“酸雨”是防治大气污染的重要问题之一。煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用Ca(ClO)2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)Ca(ClO)2中氯元素的化合价为___________。
(2)工业上制备Ca(ClO)2的化学方程式_________________________________________________。
(3)实验室在鼓泡反应器中通入含有SO2的烟气,反应温度为323 K,Ca(ClO)2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42 | Cl |
c/(mol·L1) | 5×103 | 1×102 |
写出Ca(ClO)2溶液在脱硫过程中主要反应的离子方程式____________________________________。
(4)目前可用电化学方法处理由二氧化硫引起的酸雨。常见的一种方法是惰性电极电解氢溴酸,其阳极的电极反应为:___________________________________。阴极的电极反应为:_________________________________。总反应的化学方程式为:___________________________。
(5)将其阳极产物用水溶解配成溶液去淋洗含二氧化硫的废气。上述吸收废气发生的反应化学方程式为:________________________________________。若反应中转移电子1mol,则可吸收二氧化硫气体体积在标准状况下为_________L。
【答案】 +1价 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O ClO-+H2O+SO2=SO42-+Cl-+2H+ 2Br--2e-=Br2 2H++2e-=H2↑ ![]() Br2+SO2+2H2O=2H2SO4+ 2HBr 11.2L
Br2+SO2+2H2O=2H2SO4+ 2HBr 11.2L
【解析】(1)Ca(ClO)2中氯元素的化合价为+1。
(2)工业上制备Ca(ClO)2的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(3)由表中数据可知,反应中二氧化硫被氧化为硫酸根、次氯酸根被还原为氯离子,因此,Ca(ClO)2溶液在脱硫过程中主要反应的离子方程式为ClO-+H2O+SO2=SO42-+Cl-+2H+。
(4)惰性电极电解氢溴酸,其阳极的电极反应为2Br--2e-=Br2,阴极的电极反应为2H++2e-=H2 ↑。总反应的化学方程式为: ![]() 。
。
(5)将其阳极产物用水溶解配成溶液去淋洗含二氧化硫的废气。上述吸收废气发生的反应化学方程式为Br2+SO2+2H2O=2H2SO4+ 2HBr。若反应中转移电子1mol,则可吸收二氧化硫气体的物质的量为0.5mol,在标准状况下为11.2L L。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案