��Ŀ����
����Ŀ��̽��Ũ�ȶԻ�ѧƽ���Ӱ�죬ʵ�����£�
I����5mL 0.05mol/L FeCl3��Һ�м���5mL 0.05mol/L KI��Һ����Ӧa����ƽ����Ϊ���ȷ�
����һ�ݼ��뱥��KSCN��Һ����죨��Ӧb��������CCl4�������ã��²��Լ�dz����ɫ
������һ�ݼ���CCl4�������ã��²����Ϻ�ɫ
���ʵ�飬����˵������ȷ����
A. ��ӦaΪ��2Fe3++ 2I-![]() 2Fe2++I2
2Fe2++I2
B. ���У���Ӧa���еij̶ȴ��ڷ�Ӧb
C. �Ƚ������ԣ����У�I2>Fe3+
D. �Ƚ�ˮ��Һ��c(Fe2+)����<��
���𰸡�B
��������A.�����Ӿ��������ԣ���ӦaΪ��2Fe3++2I-![]() 2Fe2++I2��A��ȷ��B.��һ�ݼ��뱥��KSCN��Һ����죨��Ӧb������˵�����У���Ӧa���еij̶�С�ڷ�Ӧb��B����C.����CCl4�������ã��²��Լ�dz����ɫ����˵�����ɵĵ���٣��������ԣ����У�I2>Fe3+��C��ȷ��D.����һ�ݼ���CCl4�������ã��²����Ϻ�ɫ��˵���д����ĵ����ɣ���˱�Ȼ�������������ɣ���ˮ��Һ��c(Fe2+)����<��D��ȷ����ѡB��
2Fe2++I2��A��ȷ��B.��һ�ݼ��뱥��KSCN��Һ����죨��Ӧb������˵�����У���Ӧa���еij̶�С�ڷ�Ӧb��B����C.����CCl4�������ã��²��Լ�dz����ɫ����˵�����ɵĵ���٣��������ԣ����У�I2>Fe3+��C��ȷ��D.����һ�ݼ���CCl4�������ã��²����Ϻ�ɫ��˵���д����ĵ����ɣ���˱�Ȼ�������������ɣ���ˮ��Һ��c(Fe2+)����<��D��ȷ����ѡB��

����Ŀ������ʵ���о��к���ɫ����������Աȷ������ý��۲���ȷ���ǣ�������
|
|
|
�� | �� | �� |
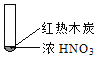
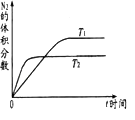
A. �����еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B. ����ɫ���岻�ܱ�������ľ̿��Ũ��������˷�Ӧ
C. ����˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D. ������������м���CO2���ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ
����Ŀ���±�ΪԪ�����ڱ���һ���֣������г�11��Ԫ�������ڱ��е�λ�ã���Ҫ��ش����и��⣺
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� | �� |
��1����11��Ԫ���У���ѧ��������õ�Ԫ����______����Ԫ�ط��ţ���ͬ�����õ���������ǿ��ԭ����______��ʧ����������ǿ�ĵ�����ˮ��Ӧ�Ļ�ѧ����ʽ��________________________�������µ���ΪҺ̬�ķǽ���������____________��
��2��Ԫ�آܵ����ӽṹʾ��ͼΪ__________________��
��3���ٺ͢�����Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽΪ___________________��
�ں͢�����Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽΪ___________________��
�ڵ�����������Ӧˮ�����ˮ��Һ��ݵ���������ﷴӦ�Ļ�ѧ����ʽΪ_________��