题目内容
【题目】I.近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2 L 密闭容器内,400 ℃时反应:CO(g)+2H(g) ![]() CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示CH3OH 的变化的曲线是_______。

(2)用H2 表示从0~2s 内该反应的平均速率v(H2)=______。
(3)能说明该反应已达到平衡状态的是______。
a.v(CH3OH)=2v(H2) b.容器内压强保持不变
c.2V 逆(CO)= v 正(H2) d.容器内密度保持不变
(4) CH3OH 与O2的反应可将化学能转化为电能,其工作原理如右图所示,图中CH3OH 从______(填A 或B)通入, b 极的电极反应式是______。
II.某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①: 把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②: 把纯锌片投入到含FeCl3 的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③: 在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是_______________。 t2~t3速率变化的主要原因是______________。
(2)实验②放出氢气的量减少的原因是________。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?_____ (填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:________________。
b、若正确则写出实验③中原电池的正极电极反应式________________。
【答案】 b 0.006mol/(Ls) bc A O2+4e-+2H2O=4OH- 反应放热,溶液温度升高,反应速率加快 随反应进行,盐酸的浓度减小较大,反应速度减慢 Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少 正确 2H++2e-=H2↑
【解析】(1) CH3OH是产物,随反应进行其物质的量增大;平衡时甲醇物质的量为CO物质的量的变化量n(CO),图表中CO的物质的量0-3s变化0.02-0.007=0.013mol,浓度变化为0.013/2=0.0065mol/L,所以甲醇浓度变化量为0.0065mol/L,所以图象中只有b符合;正确答案:b。
(2) 0~2s内CO物质的量变化0.02-0.008=0.012 mol,v(CO)=0.012/2×2=0.003 mol/(Ls),平均速率v(H2)=2v(CO)= 0.006mol/(Ls),正确答案:0.006mol/(Ls)。
(3)v(CH3OH)=2v(H2) 不符合反应速率之比等于化学方程式计量数之比,不能说明反应已达到平衡状态,a错误;反应前后气体物质的量变化,当容器内压强保持不变说明反应达到平衡状态,b正确;2V逆(CO)=v正(H2),反应速率之比等于化学方程式计量数之比,两种物质的速率方向相反,反应达到平衡状态,c正确;根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,d错误;正确选项bc。
(4)电子由a流向b说明a为负极,b为正极, CH3OH与O2的反应可将化学能转化为电能,甲醇失电子发生氧化反应,所以CH3OH从A通,B通入氧气,b电极发生的电极反应为氧气得到电子生成氢氧根离子,电极反应为: O2+4e-+2H2O=4OH- ;正确答案: A;O2+4e-+2H2O=4OH-。
II. (1)开始温度起主要作用,纯锌与稀盐酸反应,放出热量,温度升高, t1~t2速率加快;后期c(H+)起主导作用,随着反应进行c(H+)降低, t2~t3反应速率减慢;正确答案:反应放热,溶液温度升高,反应速率加快;随反应进行,盐酸的浓度减小较大,反应速度减慢。
(2)锌片与氯化铁反应,导致与盐酸反应的锌的质量减少,生成氢气量减少;正确答案: Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少。
(3)实验(3)中锌与铜离子发生置换反应生成金属铜,生成的铜与锌形成了原电池,锌为负极,铜为正极,负极电极反应式为:Zn-2e-=Zn2+, H+在正极发生还原反应,电极反应式为: 2H++2e-=H2↑,综上反应速率加快的主要原因是因为形成了原电池,此推理正确;正确答案: 正确;2H++2e-=H2↑。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案【题目】Ⅰ已知34Se的原子结构示意图如图所示,回答下列问题:

(1)Se在元素周期表中的位置是__________。
(2)由Se在周期表中的位置分析判断下列说法正确的是__________。
A.热稳定性:PH3>H2S>H2Se B.还原性:H2Se>HBr>HCl
C.离子半径:Se2->Cl->K+ D.酸性:HClO3>HBrO3>H2SeO3
Ⅱ在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
化学方程式 | K(t1) | K(t2) |
F2+H2===2HF | 1.8×1036 | 1.9×1032 |
Cl2+H2===2HCl | 9.7×1012 | 4.2×1011 |
Br2+H2===2HBr | 5.6×107 | 9.3×106 |
I2+H2===2HI | 43 | 34 |
(1)已知,HX的生成反应是放热反应,则温度t2__________t1(填“<”或“>”)。
(2)用电子式表示HX的形成过程__________。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是__________。
(4)X2都能与H2反应生成HX,用原子结构解释原因:__________。
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,__________(选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低 b.HX的稳定性逐渐减弱
c.X2与H2反应的剧烈程度逐渐减弱 d.HX的还原性逐渐减弱
(7)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式__________.
【答案】 第4周期第ⅥA族 BC > ![]() HF、HCl、HBr、HI 卤素原子的最外层电子数都是7 同一主族元素从上至下原子核外电子层数依次增多 ab BrCl+SO2+2H2O=H2SO4+HCl+HBr
HF、HCl、HBr、HI 卤素原子的最外层电子数都是7 同一主族元素从上至下原子核外电子层数依次增多 ab BrCl+SO2+2H2O=H2SO4+HCl+HBr
【解析】I.(1). 根据Se的原子结构示意图可知,Se有四个电子层,最外层有6个电子,因电子层数等于周期数、最外层电子数等于主族序数,所以Se元素位于元素周期表的第4周期第VIA族,故答案为:第4周期第VIA族;
(2) A. 同一周期从左到右元素的非金属性逐渐增强,同一主族从上到下元素的非金属性逐渐减弱,则非金属性S>P、S>Se,又因元素的非金属性越强,其气态氢化物热稳定性越强,所以热稳定性H2S>PH3、H2S>H2Se,故A错误;B. 非金属性Cl>Br>Se,因非金属性越强,其对应阴离子的还原性越弱,则还原性:H2Se>HBr>HCl,故B正确;C. 电子层数越多,离子半径越大,则离子半径Se2->Cl-,具有相同核外电子排布的离子,原子序数越大,离子半径越小,则离子半径Cl->K+,所以离子半径:Se2->Cl->K+,故C正确;D. 最高价氧化物对应的水化物酸性越强,元素的非金属性越强,但HClO3、HBrO3、H2SeO3均不是该元素的最高价氧化物对应的水化物,所以无法比较酸性强弱,故D错误;答案选BC;
II. (1). 因HX的生成反应是放热反应,则升高温度,平衡逆向移动,平衡常数减小,由表中数据可知,K(t1)>K(t2),说明t2>t1,故答案为:>;
(2). 因HX都是共价化合物,氢原子最外层电子与X原子最外层电子形成一对共用电子对,其形成过程可表示为:![]() ,故答案为:
,故答案为:![]() ;
;
(3). F、Cl、Br、I属于ⅦA族元素,同主族元素自上而下随着核电荷数的增大,原子核外电子层数逐渐增多,导致原子半径逐渐增大,因此原子核对最外层电子的吸引力逐渐减弱,从而导致非金属性逐渐减弱,即这四种元素得到电子的能力逐渐减弱,所以HF键的极性最强,HI的极性最弱,因此HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI,故答案为:HF、HCl、HBr、HI;
(4). 卤素原子的最外层电子数均为7个,在反应中均易得到1个电子而达到8电子的稳定结构,而H原子最外层有一个电子,在反应中也能得到1个电子而达到2电子的稳定结构,因此卤素单质与氢气化合时易通过一对共用电子对形成化合物HX,故答案为:卤素原子的最外层电子数都是7;
(5). 平衡常数越大,说明反应越易进行,F. Cl、Br、I的得电子能力依次减小的主要原因是:同一主族元素从上至下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱造成的,故答案为:同一主族元素从上至下原子核外电子层数依次增多;
(6). a. K值越大,说明反应的正向程度越大,即转化率越高,故a正确;b. 反应的正向程度越小,说明生成物越不稳定,故b正确;而选项c、d都与K的大小无直接关系,故c、d错误;答案选ab;
(7). 不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近,根据氯气与二氧化硫反应生成HCl和硫酸的原理可以推断BrCl和SO2在水溶液中发生反应的化学方程式为:BrCl+SO2+2H2O=H2SO4+HCl+HBr,故答案为:BrCl+SO2+2H2O=H2SO4+HCl+HBr。
【题型】综合题
【结束】
16
【题目】CH4超干重整CO2技术可得到富含CO的气体,用于生产多种化工产品。该技术中的化学反应为:CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH=+330kJ/mol
2H2O(g)+4CO(g) ΔH=+330kJ/mol
(1)下图表示初始投料比n(CH4):n(CO2)为1:3或1:4,CH4的转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用a1、a2表示]
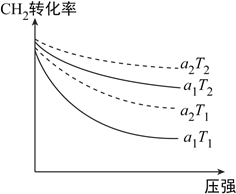
①a2=__________。
②判断T1的T2的大小关系,并说明理由:__________。
(2)CH4超干重整CO2的催化转化原理示意图如下:

①过程Ⅰ,生成1mol H2时吸收123.5kJ热量,其热化学方程式是__________。
②过程Ⅱ,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是__________。
③假设过程Ⅰ和过程Ⅱ中的各步均转化完全,下列说法正确的是__________。(填序号)
a.过程Ⅰ和过程Ⅱ中发生了氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4和CaCO3
c.若过程Ⅰ投料![]() ,可导致过程Ⅱ中催化剂失效
,可导致过程Ⅱ中催化剂失效