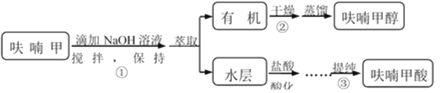
题目内容
【题目】已知298K时,某碱MOH的电离平衡常数Kb=1.0×10-5;电离度a=![]() 。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
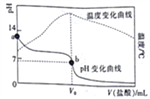
A. a点对应的溶液中:c(OH-)=(M+)+<(H+)
B. b点对应的V。=20.00mL
C. 298K时,0.1000mol/LMOH溶液中,MOH的电离度a=1%
D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,溶液的pH>9
【答案】D
【解析】A. a点为0.1000mol/LMOH溶液,存在电荷守恒,c(OH-)=c(M+)+c(H+),故A正确;B. b点溶液显酸性,若V。=20.00mL,则恰好生成MCl,水解显酸性,与图像吻合,故B正确;C. 298K时,MOH的电离平衡常数Kb=1.0×10-5,0.1000mol/LMOH溶液中,1.0×10-5=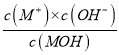 =
=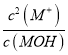 =
=![]() ,则c(M+)=1.0×10-3,因此MOH的电离度a=
,则c(M+)=1.0×10-3,因此MOH的电离度a=![]() ×100%=1%,故C正确;D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,假设电离的MOH的物质的量为x,则Kb=1.0×10-5=
×100%=1%,故C正确;D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,假设电离的MOH的物质的量为x,则Kb=1.0×10-5=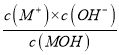 =
=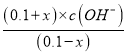 ,加入MCl抑制MOH的电离,MOH的电离度<1%,则x<0.001,因此c(OH-)<1.0×10-5,则c(H+)>1.0×10-9,pH<9,故D错误;故选D。
,加入MCl抑制MOH的电离,MOH的电离度<1%,则x<0.001,因此c(OH-)<1.0×10-5,则c(H+)>1.0×10-9,pH<9,故D错误;故选D。

【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式是________________________,常温下单质为液态的非金属单质是____________。
(2)元素④的离子结构示意图为__________________。
(3)①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为___________________。
②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为___________________。
②的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为_________。