题目内容
2.饱和一元醇R(C5H12O)以银为催化剂进行催化氧化得醛M,再经过酸性KMnO4氧化最终得到羧酸N,则R与N最多可形成酯( )| A. | 9种 | B. | 16种 | C. | 32种 | D. | 64种 |
分析 饱和一元醇R(C5H12O)以银为催化剂进行催化氧化得醛M,再经过酸性KMnO4氧化最终得到羧酸N,该醇能够被催化氧化生成羧酸,则醇中含有-CH2OH基团,满足条件的醇M的结构简式有:CH3CH2CH2CH2CH2OH、CH3CH(CH3)CH2CH2OH、C(CH3)3CH2OH、CH3CH2CH(CH3)CH2OH,总共四种;N为醇M催化氧化生成的,其分子式为:C5H10O2,将CH2OH换成-COOH即可得到对应羧酸N,则N也有4种结构,据此判断R和N总共可以形成的酯的种类.
解答 解:饱和一元醇R(C5H12O)以银为催化剂进行催化氧化得醛M,再经过酸性KMnO4氧化最终得到羧酸N,该醇能够被催化氧化生成羧酸,则醇中含有-CH2OH基团,满足条件的醇M的结构简式有:CH3CH2CH2CH2CH2OH、CH3CH(CH3)CH2CH2OH、C(CH3)3CH2OH、CH3CH2CH(CH3)CH2OH,总共四种;N为醇M催化氧化生成的,其分子式为:C5H10O2,将CH2OH换成-COOH即可得到对应羧酸N,则N也有4种结构,
所以R与N最多可形成酯的种类为:4×4=16,
故选B.
点评 本题考查了同分异构体数目的计算,题目难度中等,注意掌握同分异构体的概念及书写方法,明确R、N的结构要求为解答关键,试题培养了学生的分析、理解能力及逻辑推理能力.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
12.下列说法正确的是( )
| A. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| B. | 向酒精灯内添加酒精时,酒精量不能超过酒精灯容积的2/3,若不慎洒出的酒精在桌上燃烧,应迅速用水浇灭 | |
| C. | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液的红色变浅,则证明Na2CO3溶液中存在水解平衡 | |
| D. | 在“金属析氢腐蚀”的对比实验中,外面缠绕着铜丝的铁钉上产生气泡多,若滴加几滴KSCN溶液,则在铁钉周围出现血红色 |
10.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 信息产业中光纤的主要成分是单质硅 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 医学上,血液透析是利用了胶体的渗析原理 |
17.室温时,HA溶液和HB溶液分别加水稀释,溶液的pH变化如图所示.下列说法不正确的是( )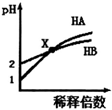

| A. | HB一定是弱酸 | |
| B. | 在x点,c(A-)=c(B-) | |
| C. | 稀释前由水电离出的c(H+),HB溶液是HA溶液的10倍 | |
| D. | 取x点时的两种酸溶液,分别中和等体积等浓度的NaOH溶液,消耗HA溶液的体积一定小于HB溶液的体积 |
7.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 在一定条件下,0.2 mol SO2和0.1 mol O2充分反应,生成SO3的分子数为0.2 NA | |
| B. | 1 L 0.1 mol/L的Na2CO3溶液中阴离子的个数是0.1 NA | |
| C. | 常温常压下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1 NA | |
| D. | 常温常压下,2 g D2O含有的质子数为NA |
14.降低太气中CO2含量及有效开发利用CO2,是科学家研究的重要课题.
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=122.4kJ•mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示.
则P1>P3 (填“>”“<”或“=”,下同).若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1<K3.T1、P1时H2的平衡转化率为57.14%.
②一定条件下,上述反应在密闭容器中达平衡.当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是cd.
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,$\frac{c(HC{O}_{3})}{c(C{O}_{3}^{2-})}$增大(填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:b.
a.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
b.c(HCO3-)>c(CO32-)
c.降低温度,c(H+)•c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑.
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=122.4kJ•mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示.
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
②一定条件下,上述反应在密闭容器中达平衡.当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是cd.
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,$\frac{c(HC{O}_{3})}{c(C{O}_{3}^{2-})}$增大(填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:b.
a.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
b.c(HCO3-)>c(CO32-)
c.降低温度,c(H+)•c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑.
11.下列说法不正确的是( )
| A. | 着火时应立即灭火,一般的小火应用湿布、石棉布或沙子覆盖燃烧物,衣服着火时应迅速脱下衣服或用石棉布覆盖着火处 | |
| B. | 乙酸乙酯中少量乙醇杂质可加水除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| C. | 取5 mL 0.1 mol•L-1 KI溶液,滴加0.1 mol•L-1FeCl3溶液5~6滴,再加入2 mL CCl4,充分振荡后静置,取上层溶液滴加KSCN溶液,溶液变色 | |
| D. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 |
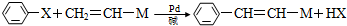 (X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下:
(X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下: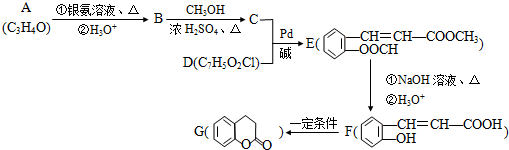
 .
. .
.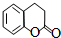 )常作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(
)常作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(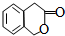 )需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.
)需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液. (R、R′为烃基).以苯、丙烯(CH2=CH-CH3)为原料,制备
(R、R′为烃基).以苯、丙烯(CH2=CH-CH3)为原料,制备 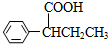 的合成路线流程图如下,请补充完整流程图(无机试剂任选).
的合成路线流程图如下,请补充完整流程图(无机试剂任选).
 Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.
Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.