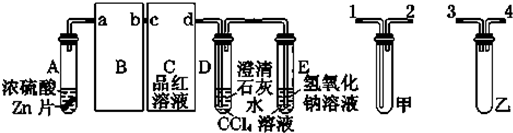
题目内容
16.黄色固体聚合硫酸铁SPFS(组成为Fex(OH)y(SO4)z•nH2O)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用.
(1)绿矾的化学式是FeSO4•7H2O.上述绿矾与NaClO3溶液反应的离子方程式是6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O.
(2)测定组成:取12.10g上述SPFS溶解于水,配成200mL溶液,分成二等份,向其中一份加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀9.32g.另一份中加入足量的还原剂(不含铁元素),将Fe3+转化为Fe2+.然后取50.00mL转化后的溶液.用0.100mol•L-1酸性高锰酸钾溶液滴定产生的Fe2+,消耗酸性高锰酸钾溶液30.00mL.
①滴定终点的现象判断是溶液由无色变浅紫红色(或无色),且半分钟不褪色.
②该SPFS的化学式是Fe3(OH)(SO4)4•2H2O(写出解题过程).
分析 (1)绿矾为七水硫酸亚铁;氯酸根离子具有氧化性,亚铁离子具有还原性,反应中二价铁离子被氧化生成三价铁离子,次氯酸根离子被还原为氯离子,依据得失电子守恒及原子个数守恒书写方程式;
(2)①高锰酸钾具有强氧化性,把亚铁离子氧化成铁离子,当亚铁离子消耗完,再滴入高锰酸钾,显示高锰酸钾的颜色,溶液由黄色变为紫色,据此解答;
②根据原子守恒和电荷守恒来计算.
解答 解:(1)绿矾为七水硫酸亚铁,化学式:FeSO4•7H2O;
二价铁离子与次氯酸根离子在酸性环境下反应,二价铁离子被氧化生成三价铁离子,次氯酸根离子被还原为氯离子,依据得失电子守恒及原子个数守恒,反应的离子方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O;
故答案为:FeSO4•7H2O; 6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O;
(2))①亚铁离子显浅绿色,高锰酸钾溶液显紫红色,高锰酸钾具有强氧化性,把亚铁离子氧化成铁离子,当亚铁离子消耗完,再滴入高锰酸钾,显示高锰酸钾的颜色,溶液由浅绿色变为紫红色;
故答案为:溶液由浅绿色变为紫红色,且半分钟不褪色;
②100mL溶液中n(SO42-)=n(BaSO4)=9.32g÷233g•mol-1=0.04mol;依据二价铁离子与高锰酸根离子反应方程式可知:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5 1
c(Fe2+)×50mL 0.100mol/L×30mL
c(Fe2+)=5×0.100mol/L×30mL÷50mL=0.3mol/L
100mL溶液中含有n(Fe3+)=0.3mol/L×0.1L=0.03mol
根据Fex(OH)y(SO4)z•nH2O,x:z=0.03mol:0.04mol=3:4,即x=3,z=4,则利用化合价守恒得:3x=y+2z,即3×3=y+2×4,y=1,
即SPFS的化学式可写成是Fe3(OH)(SO4)4•nH2O,100mL溶液溶质为0.01mol,故0.01mol×(56×3+17+96×4+18n)g•mol-1×2=12.10g,
解得:n=2,故化学式是Fe3(OH)(SO4)4•2H2O;
故答案为:Fe3(OH)(SO4)4•2H2O
点评 本题考查了聚合硫酸铁分子式的确定,明确工艺流程及发生的反应是解题关键,注意原子个数、得失电子数守恒的运用,题目难度中等.

| A. | ②④①③⑤ | B. | ④②①⑤③ | C. | ⑤③①④② | D. | ②④⑤①③ |
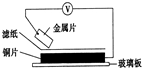
| A. | 若金属片为锌片,溶液为稀硫酸,则电子由铜片流向锌片 | |
| B. | 若金属片为铁片,溶液为氯化钠,则正极发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 若金属片为铁片,溶液为氯化钠,为防止铁片发生吸氧腐蚀,可以将铜片换成锡片 | |
| D. | 若滤纸浸有盐溶液,金属片分别用锌片和铁片接入,伏特表“示数”接入锌片的大 |
 现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
| A. | V≥$\frac{1}{18}$ | B. | V≤$\frac{1}{23}$ | C. | V<$\frac{1}{18}$ | D. | V≤$\frac{1}{56}$ |

| A. | 最高价氧化物水化物的酸性:乙<丁 | |
| B. | 甲形成化合物种类最多的元素 | |
| C. | 戊元素位于第4周期第VIIB族 | |
| D. | 乙、丙的最高价氧化物的水化物可以反应 |
| A. | FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| B. | 苯酚钠溶液中通入少量CO2: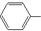 O-+CO2+H2O→ O-+CO2+H2O→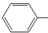 OH+HCO3- OH+HCO3- | |
| C. | NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++2HCO3-+2OH-═CaCO3↓+H2O+CO32- | |
| D. | BaCO3固体中加入足量稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.