题目内容
8.如表是元素周期表的一部分,丙为地壳中含量最高的金属.下列说法不正确的是( )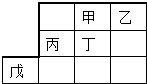
| A. | 最高价氧化物水化物的酸性:乙<丁 | |
| B. | 甲形成化合物种类最多的元素 | |
| C. | 戊元素位于第4周期第VIIB族 | |
| D. | 乙、丙的最高价氧化物的水化物可以反应 |
分析 丙为地壳中含量最高的金属,那么丙为Al,那么甲为碳、乙为氮、丁为硅、戊为锌,据此解答即可.
解答 解:地壳中含量最高的金属为Al,据此可以得出甲为碳、乙为氮、丁为硅、戊为锌,
A、乙为N,形成的最高价氧化物的水化物为硝酸,硝酸酸性强于硅酸,故A错误;
B、甲为C元素,C形成的有机物种类繁多,故B正确;
C、戊是Zn,处于元素周期表中第四周期第IIB族,故C错误;
D、硝酸与氢氧化铝可以发生中和反应硝酸铝和水,故D正确,
故选AC.
点评 本题主要考查的是元素的推断以及元素化合物的知识,熟练记忆地壳中含量最高的金属元素与非金属元素是解决本题的关键,难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
18.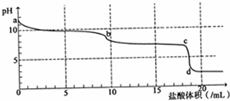 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A. | a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) | |
| B. | 当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | b-c段发生的反应为:HCO3-+H+=CO2↑+H2O |
3.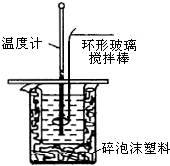 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)NaOH溶液稍过量的原因确保硫酸被完全中和.
(2)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(4)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l);△H=-113.7kJ•mol-1.
(5)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于(填“小于”、“等于”或“大于”)57.3kJ,原因是浓硫酸溶于水放出热量.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)NaOH溶液稍过量的原因确保硫酸被完全中和.
(2)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(4)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l);△H=-113.7kJ•mol-1.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
20.化学与社会息息相关,下列物质在社会、生活中的应用及解释都正确的是( )
| 选项 | 应用 | 解释 |
| A | 高纯硅作计算机芯片的材料 | 硅晶体在自然界中能稳定存在 |
| B | 在入海口的钢铁闸门上装一定数量的锌块防止闸门被腐蚀 | 利用外加电流的阴极保护法保护金属 |
| C | 高铁车厢采用铝合金材料 | 铝合金强度大,质量轻,不与氧气反应 |
| D | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 其作用是吸收水果释放出的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
17.下列离子方程式与所述事实相符且正确的是( )
| A. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向次氯酸钙溶液中通入过量CO2:2ClO-+Ca2++H2O+CO2═2HClO+CaCO3↓ | |
| C. | 向含0.015 molNaOH的溶液中通入0.64 g SO2:3OH-+2SO2═SO32-+HSO3-+H2O | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
13.下表中的数据是破坏或生成1mol物质中的化学键所消耗或吸收的能量(单位:kJ):
根据上述数据回答:
(1)下列氢化物中最稳定的是A(填序号).
A.HCl B.HRr C.HI
(2)有表中数据推知反应I2+H2=2HI释放能量(填“吸收”或“释放”).
(3)相同条件下,X2(X代表Cl、Rr、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的能量最多的是Cl2(填化合物的方程式).
(4)若无上表中的数据,你能正确回答出问题(3)吗?
答:能(填“能”或“不能”);简述你的理由同主族元素按I、Br、Cl的顺序原子得电子能力渐强,生成的HX越趋稳定,相应释放出能量越多.
根据上述数据回答:
| 物质 | Cl2 | Rr2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
A.HCl B.HRr C.HI
(2)有表中数据推知反应I2+H2=2HI释放能量(填“吸收”或“释放”).
(3)相同条件下,X2(X代表Cl、Rr、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的能量最多的是Cl2(填化合物的方程式).
(4)若无上表中的数据,你能正确回答出问题(3)吗?
答:能(填“能”或“不能”);简述你的理由同主族元素按I、Br、Cl的顺序原子得电子能力渐强,生成的HX越趋稳定,相应释放出能量越多.
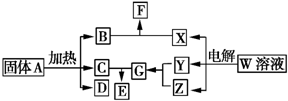 如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子.
如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子. ;E中含有的化学键类型是离子键和共价键.
;E中含有的化学键类型是离子键和共价键.
 原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.