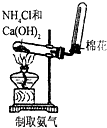
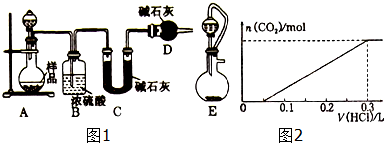
题目内容
13.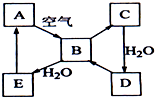 如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.(1)写出A在加热条件下与H2反应的化学方程式H2+S$\frac{\underline{\;\;△\;\;}}{\;}$H2S;
(2)写出E与A的氢化物反应生成A的化学方程式H2SO3+2H2S═3S↓+3H2O;
(3)写出一个由D生成B的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等;
(4)将5mL0.10mol•L-1的E溶液与10mL0.10mol•L-1的NaOH溶液混合.写出反应的离子方程式H2SO3+2OH-═SO32-+2H2O;
(5)E溶液久置于空气中,溶液pH将变小(填“变大”、“不”变、“变小”),用化学方程式说明理由2H2SO3 +O2=2H2SO4.
分析 A为淡黄色固体单质,应为S,由转化关系可知B为SO2,C为SO3,它们的相对分子质量为64:80=4:5,恰好与题意相符,则D为H2SO4,它是一种重要的工业原料,与题意也相符,SO2和水反应生成E为H2SO3,结合物质的性质以及题目要求可解答该题.
解答 解:A为淡黄色固体单质,应为S,由转化关系可知B为SO2,C为SO3,它们的相对分子质量为64:80=4:5,恰好与题意相符,则D为H2SO4,它是一种重要的工业原料,与题意也相符,SO2和水反应生成E为H2SO3,
(1)A为S,可与氢气反应生成硫化氢,反应的方程式为H2+S$\frac{\underline{\;\;△\;\;}}{\;}$H2S,故答案为:H2+S$\frac{\underline{\;\;△\;\;}}{\;}$H2S;
(2)H2SO3与H2S反应生成S,反应的方程式为H2SO3+2H2S═3S↓+3H2O,故答案为:H2SO3+2H2S═3S↓+3H2O;
(3)浓硫酸可与C、Cu等还原性物质在加热的条件下反应生成SO2,反应的方程式可为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等;
(4)将5mL 0.10mol•L-1的H2SO3溶液与10mL 0.10mol•L-1的NaOH溶液混合,二者恰好反应,反应的离子方程式为H2SO3+2OH-═SO32-+2H2O,
故答案为:H2SO3+2OH-═SO32-+2H2O;
(5)E为H2SO3在空气中容易变质而生成D为H2SO4,反应的化学方程式为:2H2SO3 +O2=2H2SO4,硫酸为强酸,溶液pH变小,故答案为:变小;2H2SO3 +O2=2H2SO4.
点评 本题考查无机物的推断,为高频考点,侧重学生的分析能力的考查,注意淡黄色固体单质为该题的突破口进行推断,注意把握物质的化学性质,能熟练书写反应的化学方程式.

 名校课堂系列答案
名校课堂系列答案
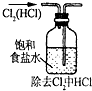
(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是分液漏斗,请写出该反应相应的化学方程式:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是d(填字母编号).
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)装置F的作用是吸收多余的氯气,防止污染大气,其烧杯中的溶液 不能选用下列中的b(填字母编号).
a.饱和NaOH溶液
b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液
d.饱和Na2CO3溶液.
| A. | 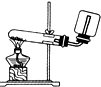 实验室制取并收集NH3 | B. | 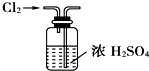 干燥Cl2 | ||
| C. | 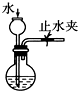 检查装置气密性 | D. |  利用排空气法收集CO2 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑩ | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)比较①与②两种元素原子半径的大小,其中较大的是C(填元素符号);
(3)元素③与⑦的氢化物分别为HF和H2S(填化学式),两种氢化物的热稳定性大小为:前者>后者;(填“>”、“<”或“=”)
(4)元素④与⑤的最高价氧化物的水化物分别为Mg(OH)2和Al(OH)3(填化学式),两者的碱性大小为:前者>后者;(填“>”、“<”或“=”)
(5)写出工业上以元素⑦的单质为原料制取硫酸的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,SO3+H2O═H2SO4;
(6)元素①的原子结构示意图为
 ,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3. 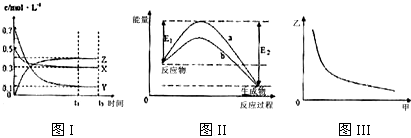
| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=-(E2-E1)kJ•mol-1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线a是加入催化剂时的能量变化曲线,曲线b是没有加入催化剂时的能量变化曲线 |
①NO2 ②CO2 ③Cl2 ④HCl ⑤NH3 ⑥H2S.
| A. | ①②③⑤ | B. | ①④⑤⑥ | C. | ②③⑤⑥ | D. | ①③⑤⑥ |
| A. | 若Va=Vb,则混合后溶液PH=7 | |
| B. | 若Va<Vb,则混合后溶液PH一定大于7 | |
| C. | 若Va=Vb,则CH3COOH与NaOH完全中和 | |
| D. | 若Va=Vb,混合的溶液中微粒浓度关系可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |