题目内容
【题目】油脂是人体所必需的营养物质。
(1)下列关于油脂的叙述不正确的是_______(填序号)。
A.利用油脂在碱性条件下的水解反应,可以生产甘油和肥皂
B.油脂在小肠内受酶的催化作用而水解,生成的高级脂肪酸和甘油作为人体营养成分为肠壁所吸收,同时提供人体活动所需要的能量
C.油脂中的碳链中的碳碳键为碳碳单键时,主要是高沸点的动物脂肪
D.油脂是人体所需的基本营养物质之一,应尽量多食用富含油脂的物质
(2)某天然油脂的结构简式如图所示。![]() 该油脂完全水解,需消耗
该油脂完全水解,需消耗![]() 的物质的量为_______mol;已知
的物质的量为_______mol;已知![]() 该油脂与氢气发生加成反应时最多需氢气8g,则
该油脂与氢气发生加成反应时最多需氢气8g,则![]() 该油脂中含碳碳双键________mol。
该油脂中含碳碳双键________mol。

【答案】D 3 4
【解析】
A.油脂属于高级脂肪酸甘油酯,所以油脂在碱性条件下能发生水解反应,生成甘油和硬脂酸钠,硬脂酸钠是肥皂的主要成分,故A正确;
B.油脂在小肠内受酶的催化作用而水解,生成的高级脂肪酸和甘油作为人体营养成分为肠壁所吸收,同时提供人体活动所需要的能量,故B正确;
C.油脂中的碳链中的碳碳键为碳碳单键时,属于饱和高级脂肪酸甘油酯,为动物脂肪,沸点较高,故C正确;
D.油脂是人体所需的基本营养物质之一,应适量摄入,过多导致人肥胖,引起各种疾病,故D错误;
故答案:D;
(2)由天然油脂的结构简式可知,![]() 该油脂含有三个酯基,完全水解需消耗3 mol的
该油脂含有三个酯基,完全水解需消耗3 mol的![]() ;已知
;已知![]() 该油脂与氢气发生加成反应时最多需8g氢气的物质的量为4 mol,每个碳碳双键消耗
该油脂与氢气发生加成反应时最多需8g氢气的物质的量为4 mol,每个碳碳双键消耗![]() 氢气,所以
氢气,所以![]() 该油脂中含碳碳双键为4mol,故答案:3;4。
该油脂中含碳碳双键为4mol,故答案:3;4。

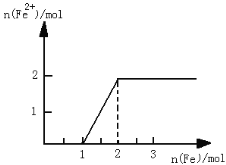
【题目】CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化, 产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
反应II:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4kJ·mol-1
2CH3OH(g) △H2=+23.4kJ·mol-1
反应III:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_____________kJ·mol-1
(2)恒温恒容条件下,在密闭容器中通人等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加人等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.6 | 1.6 | 0.8 |
此时![]() ___
___![]() (填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=____。

(5)恒压下将CO2和氏按体积比1 :3混合,在 不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性=![]() ×100%
×100%

①温度高于230℃,CH3OH产率随温度升高而下降的原因是________。
②在上述条件下合成甲醇的工业条件是_________。
A. 230℃ B. 210℃ C.催化剂 CZT D.催化剂 CZ(Zr-1)T