题目内容
【题目】已知反应:①101kPa时,O2(g) +2H2(g) = 2H2O(l) ΔH = -483.6 kJ·mol-1 ②稀溶液中,OH-(aq)+ H+(aq) = 2H2O(l) ΔH = -57.3 kJ·mol-1,又知由H2和O2两种气体反应生成1mol液态水比生成1mol气态水多放出44kJ热量.下列结论中正确的是( )
A.1mol H2完全燃烧生成液态水所放出的热量为285.8 kJ
B.H2和O2反应生成液态水时的热化学方程式为![]() O2(g) +H2(g) = H2O(l) ΔH = -571.6 kJ·mol-1
O2(g) +H2(g) = H2O(l) ΔH = -571.6 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量
【答案】A
【解析】
A选项,由反应①可知,1mol氢气燃烧生成气态水放出的热量为241.8kJ,1mol气态水变为液态水要放热44kJ,故1mol氢气完全燃烧生成液态水放出的热量285.8kJ,故A正确;
B选项,据氢气燃烧热分析,![]() O2(g) +H2(g) = H2O(l) ΔH = -285.6 kJ·mol-1,故B错误;
O2(g) +H2(g) = H2O(l) ΔH = -285.6 kJ·mol-1,故B错误;
C选项,稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ·mol-1或ΔH = -57.3 kJ·mol-1,故C错误;
D选项,醋酸是弱酸电离吸热,所以稀醋酸与稀NaOH溶液反应生成1mol水,放出热量小于57.3 kJ,故D错误。
综上所述,答案为A。

 全能练考卷系列答案
全能练考卷系列答案【题目】下列有关说法正确且解释合理的是
说法 | 解释 | |
A | 一定温度压强下,2 g H2 和 4 g H2 完全燃烧,后者 燃烧热的数值大 | 4 g H2 放出热量多 |
B | 2SO2(g)+O2(g) 平衡后再加入 SO2,Q 增大 | 平衡右移,放出热量增多 |
C | 向等物质的量浓度的 NaI 和 KBr 混合液中滴加 AgNO3 溶液,先生成黄色 AgI 沉淀 | Ksp(AgI)<Ksp(AgBr) |
D | 等物质的量浓度 Na2CO3 的 pH 大于 CH3COONa | H2CO3 的酸性比 CH3COOH 强 |
A.AB.BC.CD.D
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是______________。基态K+的电子排布式为__________________。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______________,中心原子的杂化方式为__________。NaBH4中存在__________(填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为_________________。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:__________________________。
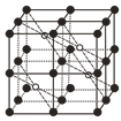
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=x pm,r(Ca2+)=y pm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=____________________g·cm-3(列出计算表达式)。