题目内容
【题目】合理利用和转化NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物污染。已知:
①![]() ;
;![]() ;
;
②![]() ,
,![]() ;
;
③![]() ,
,![]() ;
;
1 mol CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的反应热为________。
(2)已知![]() 的反应历程分两步:
的反应历程分两步:
①![]() (快);
(快);![]() ,
,![]() ;
;
②![]() (慢);
(慢);![]() ,
,![]()
一定温度下,反应![]() 达到平衡状态,该反应的平衡常数的表达式K=____(用
达到平衡状态,该反应的平衡常数的表达式K=____(用![]() 表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
(3)用活性炭还原法处理氮氧化物的有关反应为:![]() 。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
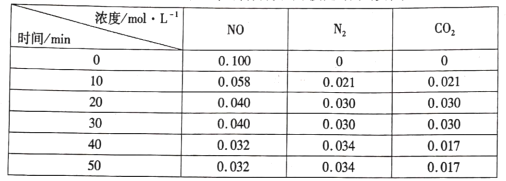
①T℃时,该反应的平衡常数的计算式为______。
②在31 min时,若只改变某一条件使平衡发生移动,40 min、50 min时各物质的浓度如上表所示,则改变的条件是____
③在51 min时,保持温度和容器体积不变再充人NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正____v逆(填“>”、“<”或“=”)。
(4)反应N2O4(g) ![]() 2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:
2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:![]() ,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
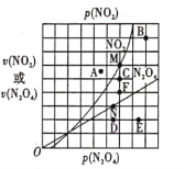
在T℃时,图中M、N点能表示该反应达到平衡状态,理由是___________ 。改变温度,v(NO2)会由M点变为A、B或C,v(N2O4)会由N点变为D、E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为_______(填字母)。
【答案】-955.0kJ/mol ![]() <
< ![]() 减小二氧化碳浓度 > M点v(NO2)是N点v(N2O4)的2倍,根据化学方程式N2O4(g)2NO2(g),可以判断出该反应的正反应速率等于逆反应速率,反应达到平衡状态 BF
减小二氧化碳浓度 > M点v(NO2)是N点v(N2O4)的2倍,根据化学方程式N2O4(g)2NO2(g),可以判断出该反应的正反应速率等于逆反应速率,反应达到平衡状态 BF
【解析】
(1)根据已知的热化学方程式和盖斯定律进行计算;
(2)平衡状态下,正逆反应速率相等,可得![]() ,
,![]() ,再列出反应
,再列出反应![]() 的平衡常数的表达式
的平衡常数的表达式![]() ,从而得出K=
,从而得出K=![]() ;反应速率越慢,说明反应的活化能越大;
;反应速率越慢,说明反应的活化能越大;
(3)①由表中数据可知,T℃时,反应![]() ,20min-30min反应处于平衡状态;40min-50min反应也处于平衡状态;温度不变,平衡常数不变,则可分别由两次平衡时各物质的浓度列出平衡常数的计算式;
,20min-30min反应处于平衡状态;40min-50min反应也处于平衡状态;温度不变,平衡常数不变,则可分别由两次平衡时各物质的浓度列出平衡常数的计算式;
②已知反应条件为恒温恒容,依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,且该反应为反应前后气体体积不变的反应,所以改变的条件应为减小二氧化碳浓度,平衡正向移动;
③先计算出该反应的平衡常数,再计算此时的浓度商,进而判断反应进行的方向,从而比较v正、v逆的大小关系;
(4)当达到化学平衡时,满足v正=v逆,即消耗速率:2v(N2O4)=v(NO2),由图可知M点v(NO2)是N点v(N2O4)的2倍,可以判断出该反应的正反应速率等于逆反应速率,反应达到平衡状态;升高温度,正、逆反应速率均加快,据此分析解答。
(1)已知的热化学方程式:①![]() ;
;![]() ;②
;②![]() ,
,![]() ;③
;③![]() ,
,![]() ;根据盖斯定律(①+②+4×③)×
;根据盖斯定律(①+②+4×③)×![]() ,可得到CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955.0kJ/mol,则1 mol CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的反应热为-955.0kJ/mol;
,可得到CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955.0kJ/mol,则1 mol CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的反应热为-955.0kJ/mol;
故答案为:-955.0kJ/mol;
(2)①![]() (快);
(快);![]() ,
,![]() ;
;
②![]() (慢);
(慢);![]() ,
,![]() ;平衡状态下,正逆反应速率相等,即
;平衡状态下,正逆反应速率相等,即![]() ,
,![]() ,一定温度下,反应
,一定温度下,反应![]() 达到平衡状态,该反应的平衡常数的表达式
达到平衡状态,该反应的平衡常数的表达式![]() =
=![]() ;反应②的反应速率慢,说明反应的活化能大,则E1<E2;
;反应②的反应速率慢,说明反应的活化能大,则E1<E2;
故答案为:![]() ;<;
;<;
(3)①由表中数据可知,T℃时,反应![]() ,20min-30min反应处于平衡状态,各物质的平衡浓度为:c(CO2)=c(N2)=0.030mol/L,c(NO)=0.040mol/L;40min-50min反应也处于平衡状态,各物质的平衡浓度为:c(CO2)=0.017 mol/L,c(N2)=0.034mol/L,c(NO)=0.032mol/L;温度不变,平衡常数不变,则反应的平衡常数为:
,20min-30min反应处于平衡状态,各物质的平衡浓度为:c(CO2)=c(N2)=0.030mol/L,c(NO)=0.040mol/L;40min-50min反应也处于平衡状态,各物质的平衡浓度为:c(CO2)=0.017 mol/L,c(N2)=0.034mol/L,c(NO)=0.032mol/L;温度不变,平衡常数不变,则反应的平衡常数为:![]() ;
;
故答案为:![]() ;
;
②在31min时,改变某一条件,反应重新达到平衡时c(CO2)=0.017 mol/L,c(N2)=0.034mol/L,c(NO)=0.032mol/L,已知反应条件为恒温恒容,依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,且该反应为反应前后气体体积不变的反应,所以改变的条件应为减小二氧化碳浓度,平衡正向移动;
故答案为:减小二氧化碳的浓度;
③该反应的平衡常数为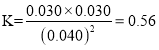 ,在51 min时,保持温度和容器体积不变再充人NO和N2,使二者的浓度均增加至原来的两倍,则此时c(CO2)=0.017 mol/L,c(N2)=0.068mol/L,c(NO)=0.064mol/L,
,在51 min时,保持温度和容器体积不变再充人NO和N2,使二者的浓度均增加至原来的两倍,则此时c(CO2)=0.017 mol/L,c(N2)=0.068mol/L,c(NO)=0.064mol/L,![]() ,
,
平衡正向移动,则v正>v逆;
故答案为:>;
(4)当达到化学平衡时,满足v正=v逆,即消耗速率:2v(N2O4)=v(NO2),M点v(NO2)是N点v(N2O4)的2倍,根据化学方程式N2O4(g)2NO2(g),可以判断出该反应的正反应速率等于逆反应速率,则在T℃时,图中M、N点能表示该反应达到平衡状态;升高温度,正、逆反应速率均加快,则反应重新达到平衡时,相应的点分别为:BF;
故答案为:M点v(NO2)是N点v(N2O4)的2倍,根据化学方程式N2O4(g)2NO2(g),可以判断出该反应的正反应速率等于逆反应速率,反应达到平衡状态;B、F。

 名题金卷系列答案
名题金卷系列答案