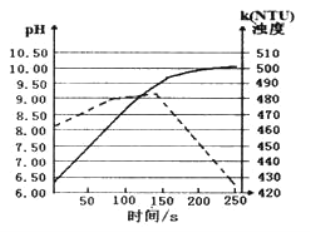
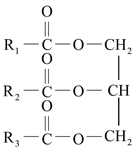
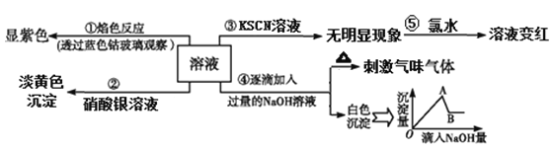
题目内容
【题目】现有NaNO3和HCl的混合溶液400mL,向混合溶液中逐渐加入过量的Fe粉,如图所示。(反应中HNO3只被还原成NO)下列说法正确的是

A. 硝酸钠的物质的量浓度为2.5mol/L
B. 标况下,反应过程共产生22.4L的气体
C. 整个反应过程中每步转移的电子之和为4mol
D. 将反应后的混合物过滤,滤液蒸发结晶所得固体为 NaCl和FeCl2的混合物
【答案】A
【解析】
溶液中,盐酸提供酸性环境,在此环境下,硝酸根具有强氧化性,能将铁单质氧化为铁离子,当硝酸根耗尽时,过量的铁与铁离子反应产生二价铁。由图可知,1mol铁与硝酸根发生反应,1mol铁与铁离子和可能剩余的氢离子发生反应。
A. 酸性环境下,1mol铁被硝酸氧化Fe+4H++NO3-=Fe3++NO↑+2H2O,参与反应硝酸根物质的量等于铁单质物质的量为1mol,故400mL硝酸钠的物质的量浓度为2.5mol/L,A正确;
B. 第一步反应产生1mol铁离子,同时生成1molNO;反应共产生2molFe2+,由于三价铁离子氧化性大于氢离子,硝酸根耗尽后,Fe3+与Fe单质反应:2Fe3++Fe=3Fe2+,此反应(第二步)消耗铁单质0.5mol,生成1.5molFe2+;由图可知,剩余0.5mol铁与氢离子反应(第三步):2H++Fe=Fe2++H2↑,产生0.5mol氢气;故反应共产生1mol+0.5mol=1.5mol气体,在标准状况下气体的体积为33.6L,B错误;
C. 整个反应过程分为三步,每步反应过程转移电子数为3mol,1mol,1mol,共转移5mol电子,C错误;
D. 将反应后的混合物过滤,滤液中溶质为NaCl和FeCl2,蒸发结晶时氯化亚铁发生水解,同时被氧化,所得固体为 NaCl和Fe2O3的混合物,D错误;
答案为A。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是______________。基态K+的电子排布式为__________________。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______________,中心原子的杂化方式为__________。NaBH4中存在__________(填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为_________________。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:__________________________。
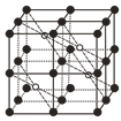
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=x pm,r(Ca2+)=y pm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=____________________g·cm-3(列出计算表达式)。