题目内容
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
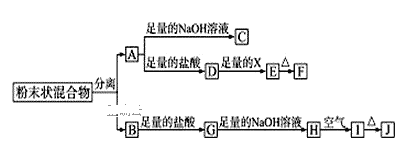
(1)写出下列物质的化学式:F___,G___。
(2)分离粉末状混合物最简单的方法是___。
(3)D→E转化中,加入足量的X,试剂X可能是___,写出其离子方程式___。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)A→C的离子方程式___。
(5)检验G溶液中的阳离子的方法___。
【答案】Al2O3 FeCl2 用磁铁石吸 C Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2OH-+2Al+2H2O=2AlO2-+3H2↑ 取少G溶液于试管中,向试管中滴入几滴KSCN溶液无现象,向的混合溶液中再加入氯水,溶液变成红色
【解析】
I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe;金属A能与盐酸、氢氧化钠溶液反应,A为金属Al,E为白色沉淀,则E为Al(OH)3,由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3。
I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe;金属A能与盐酸、氢氧化钠溶液反应,A为金属Al,E为白色沉淀,则E为Al(OH)3,由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3;
(1)由上述分析可知,F为Al2O3,G为FeCl2;
(2)混合物为铁与铝,铁具有磁性,可以利用磁铁吸出铁进行分离;
(3)D→E的转化为AlCl3→Al(OH)3,X为碱或水解为碱性的物质,加入过量的X,X不能是强碱,故X可能是氨水,故答案为C;在Al3+的溶液中滴加氨水时发生的离子反应方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(4)A→C为铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)检验FeCl2溶液中的阳离子的方法:取少G溶液于试管中,向试管中滴入几滴KSCN溶液无现象,向的混合溶液中再加入氯水,溶液变成红色。

【题目】“硫代硫酸银”( [ Ag(S2O3)2]3–)常用于切花保鲜,由AgNO3溶液(0.1 mol·L–1 、pH=6)和Na2S2O3溶液(0.1 mol·L–1、pH=7)现用现配制。某小组探究其配制方法。
(实验一)

(1)A为Ag2S2O3。写出生成A的离子方程式__________。
(2)对实验现象的分析得出,试管a中充分反应后一定生成了__________(填离子符号)。进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。做出推测的理由是__________。
(3)若试管a中物质充分反应后不过滤,继续加入1.1 mL Na2S2O3溶液,振荡,静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因:__________。
结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
(实验二)已知:Ag2S2O3 +3S2O32- ![]() 2 [ Ag(S2O3)2]3–(无色)
2 [ Ag(S2O3)2]3–(无色)
实验操作 | 实验现象 |
i. | 白色沉淀生成,振荡后迅速溶解,得到无色清液; 滴加至约1 mL时清液开始略显棕黄色,有丁达尔现象; 超过1.5 mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色; 滴加完毕,静置,得到黑色沉淀,上层清液pH = 5 |
ii. | 白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象。 |
(4)用平衡移动原理解释实验i中加入1.5 mL AgNO3后产生白色沉淀的原因:__________。
(5)实验i中,当加入0.5 mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是__________。
(6)简述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作:__________。









