题目内容
【题目】由反应物 X 转化为 Y 或 Z 的能量变化如图所示。下列说法正确的是

A.由 X→Y 反应的 ΔH=E5-E2
B.由 X→Z 反应的 ΔH=E2-E1
C.反应 2X(g)=3Y(g)的活化能=E3-E2
D.2X(g)=Z(s) ΔH<(E1-E2) kJ·molˉ1
【答案】D
【解析】
A.反应热=生成物的总能量-反应热的总能量,由X→Y反应的△H=E3-E2,故A错误;
B.反应热=生成物的总能量-反应热的总能量,由 X→Z 反应的△H=E1-E2,故B错误;
C.反应 2X(g)=3Y(g)的活化能=E5-E2,故C错误;
D.由图可知,2X(g)=Z(g)△H1=E1-E2 kJmol-1①,Z(g)→Z(s)△H2<0②,由盖斯定律:①+②得:2X(g)=Z(s)△H=△H1+△H2=E1-E2+△H2,因为△H2<0,所以2X(g)=Z(s)△H<E1-E2 kJmol-1,故D正确;
故选D。

 全能测控期末小状元系列答案
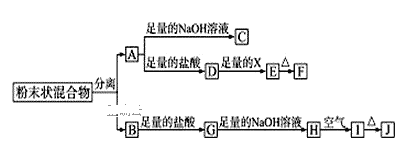
全能测控期末小状元系列答案【题目】已知某合金粉末除含铝外,还含有铁、铜中的一种或两种,某兴趣小组在老师的指导下,对合金中铁、铜的存在情况进行了如下探究。
(查阅资料)铁、铜不与氢氧化钠溶液反应。
(猜想)猜想1:该合金粉末中,除含铝外,还含有铁。
猜想2:该合金粉末中,除含铝外,还含有铜。
猜想3:该合金粉末中,除含铝外,还含有_________(填名称)。
(实验探究)下列实验仅供选择的试剂是:10%的盐酸、30%的氢氧化钠溶液。
实验方案 | 实验现象 | 结论 |
①取一定量的合金粉末,加过量的____,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气体放出。 | 合金中一定含有铝。 |
②取步骤①所得滤渣,加过量的______,充分反应。 | 滤渣粉末部分溶解,并有气体放出,溶液呈现浅绿色。 | 合金中一定含有______。 |
(探究结论)猜想3成立。
(反思)一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与氢氧化钠溶液反应的离子方程式__________。
(知识延伸)在一定条件下,铁和铝都能与水反应。写出在相应条件下,铁和水发生反应的化学方程式_______________。