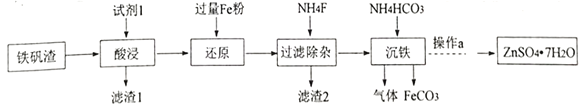
题目内容
【题目】(1)写出次氯酸的结构式________;
(2)NaHCO3的俗名是_______;
(3)第四周期第ⅦA原子序数为______,元素符号为_________,其最高价氧化物的水化物化学式为_______;
(4)写出工业上制氯气的离子方程式_______。
【答案】H-O-Cl 小苏打 35 Br HBrO4 2Cl- + 2H2O![]() 2OH -+ Cl2↑+ H2↑
2OH -+ Cl2↑+ H2↑
【解析】
(1)次氯酸是共价化合物,氧原子和氢原子、氯原子分别形成一个共价键;
(2)NaHCO3为碳酸氢钠的化学式;
(3)第四周期0族元素的原子序数为36,据此分析解答;
(4)工业上通过电解饱和食盐水制备氯气,据此书写反应的离子方程式。
(1)次氯酸是共价化合物,氧原子和氢原子、氯原子分别形成一个共价键,结构式为:H-O-Cl,故答案为:H-O-Cl;
(2)碳酸氢钠俗称小苏打,故答案为:小苏打;
(3)第四周期0族元素的原子序数为36,则元素周期表中第四周期,第ⅦA族元素的原子序数为35,为溴元素,元素符号为Br,最高价氧化物对应的水化物为HBrO4,故答案为:35;Br;HBrO4;
(4)工业上通过电解饱和食盐水制备氯气,反应的离子方程式为2Cl- + 2H2O![]() 2OH -+ Cl2↑+ H2↑,故答案为:2Cl- + 2H2O
2OH -+ Cl2↑+ H2↑,故答案为:2Cl- + 2H2O![]() 2OH -+ Cl2↑+ H2↑。
2OH -+ Cl2↑+ H2↑。

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目