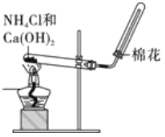
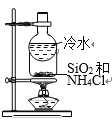
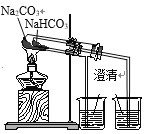
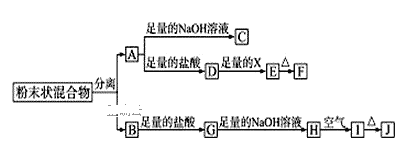
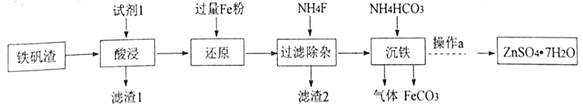
题目内容
【题目】下列离子方程式书写正确的是
A.Na2SiO3溶液中滴加盐酸:Na2SiO3 + 2H+ = H2SiO3↓ + 2Na+
B.Na2SO3水解方程式:SO32- + 2H2O![]() H2SO3 + 2OH-
H2SO3 + 2OH-
C.向FeBr2溶液通入过量Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ + 4Cl- + Br2
D.明矾中加Ba(OH)2至沉淀的质量最大:Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓+ AlO2- + 2H2O
【答案】D
【解析】
A. 向Na2SiO3溶液中滴加稀盐酸:SiO32- +2H+=H2SiO3↓,Na2SiO3是强电解质,选项A错误;
B.亚硫酸根离子的水解分步进行,其水解的离子方程式需要分步写,主要写出第一步水解即可,正确的水解离子方程式为:SO32-+H2OHSO3-+OH-,选项B错误;
C.向FeBr2溶液中通入过量的Cl2的离子方程式为2Fe2++4Br-+ 3Cl2 = 2Fe3++2Br2+6Cl-,选项C错误;
D.当沉淀的质量恰好最大时,Al3+完全转化为AlO2- ,这时离子方程式是Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓+ AlO2- + 2H2O,选项D正确。
答案选D。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】I.化合物X含有三种元素,其中两种为非金属元素,且原子个数比为1:1,X不溶于水,能溶于强酸。某研究小组为探究其组成和性质,设计并完成了如下实验。
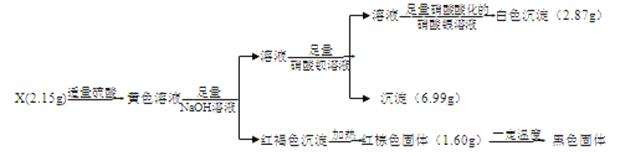
(1)X的化学式是____________________。
(2)写出检验黄色溶液中金属阳离子的实验操作:__________。
(3)黄色溶液中加入铜片,铜片表面被腐蚀,则对应的离子方程式是:_____________________。
II.已知黑色固体中不含单质。为进一步探究其组成,研究小组将上述所得固体全部溶于稀盐酸,配成100mL溶液,每次取20.00mL待测液于锥形瓶中,用2.000×10-2molL-1 KMnO4标准溶液进行滴定,并记录实验的结果如下表:
组次 | 1 | 2 | 3 | 4 |
V标(mL) | 20.00 | 20.02 | 19.99 | 19.99 |
(4)如何判断滴定终点:__________________。
(5)待测液中c(Fe2+) = ____________________。
(6)该黑色固体的化学式用FexOy形式可表示为_______________。