题目内容
【题目】硼(B)钴(Co)和锰(Mn)形成物质时比较复杂和变化多端。
(1) Co基态原子核外电子排布式为_________,第二周期元素第一电离能比B高的有______种;
(2)硝酸锰是工业制备中常用的催化剂,Mn(NO3)2中的化学键除了σ键外,还存在______;
(3)NaBO2可用于织物漂白。BO2-的空间构型为_______写出两种与其互为等电子体的分子的化学式:_______;
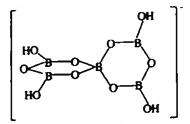
(4)下图表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____(以n表示硼原子的个数);
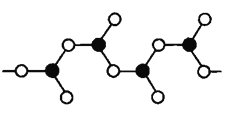
下图表示的是一种五硼酸根离子, 其中B原子的杂化方式为________;
(5)立方BN和立方AIN均为原子晶体,结构相似,BN的熔点高于AIN的原因为_______________;
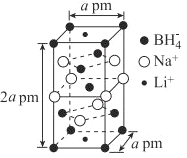
(6)一种新型轻质储氢材料的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,该晶体的密度为__gcm-3(用含a、NA的代数式表示)。
【答案】1s22s22p63s23p63d74s2或[Ar]3d74s2 6 π键、离子键 直线形 CO2或CS2或N2O或BeCl2 (BO2)nn- sp3、sp2 B原子半径更小,B-N键键长更短,键能更大 ![]()
【解析】
(1) Co 为27号元素,根据构造理论书写排布式;B位于周期表中第2周期,第ⅢA族,同周期主族元素,随着原子序数的增大,第一电离能有增大的趋势,但第ⅡA族和第ⅤA族元素反常;
(2)硝酸锰是离子化合物,硝酸根中3个氧原子和中心原子N之间形成一个4中心6电子的大π键;
(3) BO2-的中心原子的价层电子对数为2,孤电子对数为0;原子总数相等、价电子总数也相等的微粒互为等电子体;
(4) 根据均摊思想分析偏硼酸根离子的化学式,根据杂化轨道理论判断五硼酸根离子中B原子的杂化方式;
(5)原子半径越小,键长越短,键能越大,原子晶体的熔点越高;
(6)结合晶胞中各离子数目计算晶胞质量,晶体密度=晶胞质量÷晶胞体积。
(1) Co为27号元素,根据构造理论,其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2;同周期主族元素,随着原子序数的增大,随着原子序数的增大,第一电离能有增大的趋势,但第ⅡA族和第ⅤA族元素反常,所以第一电离能比B大的有Be,C,N,O,F,Ne,共有6个元素;
(2)硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中3个氧原子和中心原子N之间形成一个4中心6电子的大π键,所以除σ键外,还存在π键和离子键;
(3)BO2的中心原子的价层电子对数为2,孤电子对数为0,立体构型为直线形;与BO2由3个原子构成,价层电子数为16,互为等电子体的分子有CO2、CS2、N2O、BeCl2等;
(4)根据均摊思想,无限长链式偏硼酸根离子中,一个B相当于占有O的数目为1+2×![]() =2,所以其化学式可表示为:(BO2)n n;根据杂化轨道理论,五硼酸根离子中,B原子部分形成3根共价键,为sp2杂化,部分形成4根共价键,为sp3杂化;
=2,所以其化学式可表示为:(BO2)n n;根据杂化轨道理论,五硼酸根离子中,B原子部分形成3根共价键,为sp2杂化,部分形成4根共价键,为sp3杂化;
(5)立方BN和立方AlN均为原子晶体,B原子半径更小,BN键键长更短,键能更大,熔点更高;
(6)晶胞中,Na+位于晶胞的面上和棱上,离子数目=4×![]() +4×
+4×![]() =3;Li+位于晶胞的面心,离子数目=2×
=3;Li+位于晶胞的面心,离子数目=2×![]() =1,BH4位于顶点、面心和体心离子数目=1+4×
=1,BH4位于顶点、面心和体心离子数目=1+4×![]() +8×
+8×![]() =4,故该物质的化学式为Na3Li(BH4)4,晶胞的体积V=(a×1010cm)2×(2a×1010cm),晶胞质量=
=4,故该物质的化学式为Na3Li(BH4)4,晶胞的体积V=(a×1010cm)2×(2a×1010cm),晶胞质量=![]() g,晶体密度=
g,晶体密度=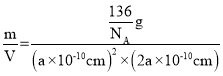 =
=![]() gcm3。
gcm3。

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】已知某合金粉末除含铝外,还含有铁、铜中的一种或两种,某兴趣小组在老师的指导下,对合金中铁、铜的存在情况进行了如下探究。
(查阅资料)铁、铜不与氢氧化钠溶液反应。
(猜想)猜想1:该合金粉末中,除含铝外,还含有铁。
猜想2:该合金粉末中,除含铝外,还含有铜。
猜想3:该合金粉末中,除含铝外,还含有_________(填名称)。
(实验探究)下列实验仅供选择的试剂是:10%的盐酸、30%的氢氧化钠溶液。
实验方案 | 实验现象 | 结论 |
①取一定量的合金粉末,加过量的____,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气体放出。 | 合金中一定含有铝。 |
②取步骤①所得滤渣,加过量的______,充分反应。 | 滤渣粉末部分溶解,并有气体放出,溶液呈现浅绿色。 | 合金中一定含有______。 |
(探究结论)猜想3成立。
(反思)一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与氢氧化钠溶液反应的离子方程式__________。
(知识延伸)在一定条件下,铁和铝都能与水反应。写出在相应条件下,铁和水发生反应的化学方程式_______________。
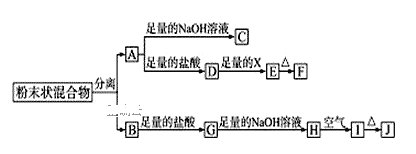
【题目】I.化合物X含有三种元素,其中两种为非金属元素,且原子个数比为1:1,X不溶于水,能溶于强酸。某研究小组为探究其组成和性质,设计并完成了如下实验。
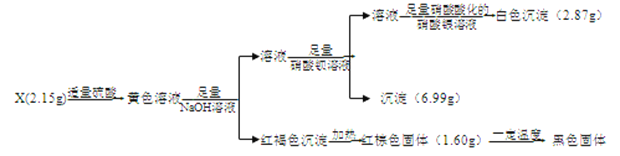
(1)X的化学式是____________________。
(2)写出检验黄色溶液中金属阳离子的实验操作:__________。
(3)黄色溶液中加入铜片,铜片表面被腐蚀,则对应的离子方程式是:_____________________。
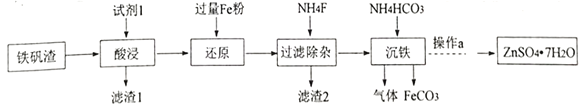
II.已知黑色固体中不含单质。为进一步探究其组成,研究小组将上述所得固体全部溶于稀盐酸,配成100mL溶液,每次取20.00mL待测液于锥形瓶中,用2.000×10-2molL-1 KMnO4标准溶液进行滴定,并记录实验的结果如下表:
组次 | 1 | 2 | 3 | 4 |
V标(mL) | 20.00 | 20.02 | 19.99 | 19.99 |
(4)如何判断滴定终点:__________________。
(5)待测液中c(Fe2+) = ____________________。
(6)该黑色固体的化学式用FexOy形式可表示为_______________。