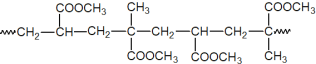
题目内容
【题目】“硫代硫酸银”( [ Ag(S2O3)2]3–)常用于切花保鲜,由AgNO3溶液(0.1 mol·L–1 、pH=6)和Na2S2O3溶液(0.1 mol·L–1、pH=7)现用现配制。某小组探究其配制方法。
(实验一)

(1)A为Ag2S2O3。写出生成A的离子方程式__________。
(2)对实验现象的分析得出,试管a中充分反应后一定生成了__________(填离子符号)。进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。做出推测的理由是__________。
(3)若试管a中物质充分反应后不过滤,继续加入1.1 mL Na2S2O3溶液,振荡,静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因:__________。
结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
(实验二)已知:Ag2S2O3 +3S2O32- ![]() 2 [ Ag(S2O3)2]3–(无色)
2 [ Ag(S2O3)2]3–(无色)
实验操作 | 实验现象 |
i. | 白色沉淀生成,振荡后迅速溶解,得到无色清液; 滴加至约1 mL时清液开始略显棕黄色,有丁达尔现象; 超过1.5 mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色; 滴加完毕,静置,得到黑色沉淀,上层清液pH = 5 |
ii. | 白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象。 |
(4)用平衡移动原理解释实验i中加入1.5 mL AgNO3后产生白色沉淀的原因:__________。
(5)实验i中,当加入0.5 mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是__________。
(6)简述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作:__________。
【答案】Ag++![]() = Ag2S2O3↓ H+、
= Ag2S2O3↓ H+、![]() 得到的
得到的![]() 是氧化产物,必然要生成其他还原产物
是氧化产物,必然要生成其他还原产物 ![]() 过量Ag+与
过量Ag+与![]() 结合,使c(
结合,使c(![]() )降低,Ag2S2O3+3S2O32-
)降低,Ag2S2O3+3S2O32-![]() 2[Ag(S2O3)2]3-逆向移动,析出沉淀 逐滴滴加AgNO3时,Ag2S2O3的溶解速率大于分解速率;迅速混合时部分Ag2S2O3来不及溶解即发生分解,分解产物不能再溶于Na2S2O3 Na2S2O3和AgNO3物质的量之比大于2:1,在不断搅拌下将AgNO3溶液缓缓加入到Na2S2O3溶液中
2[Ag(S2O3)2]3-逆向移动,析出沉淀 逐滴滴加AgNO3时,Ag2S2O3的溶解速率大于分解速率;迅速混合时部分Ag2S2O3来不及溶解即发生分解,分解产物不能再溶于Na2S2O3 Na2S2O3和AgNO3物质的量之比大于2:1,在不断搅拌下将AgNO3溶液缓缓加入到Na2S2O3溶液中
【解析】
Na2S2O3与AgNO3反应生成白色沉淀Ag2S2O3,白色沉淀立即变为棕黄色,最终变为黑色,过滤后,滤液pH=1,说明溶液中存在H+,滴入硝酸钡溶液产生白色沉淀,推断滤液中存在SO42-,说明沉淀转化为氧化还原反应。实验i中逐滴滴加硝酸银溶液,Ag2S2O3的溶解速率大于分解速率,实验ii中一次性加入硝酸银溶液,生成Ag2S2O3立即分解,分解所得固体不溶于Na2S2O3溶液,形成胶体。
(1)Na2S2O3与AgNO3反应生成A,A为白色沉淀Ag2S2O3,Na2S2O3与AgNO3为可溶性盐在离子方程式中要拆写,则离子方程式为Ag++S2O32-= Ag2S2O3↓
(2)滤液pH=1,说明溶液中存在H+,滴入硝酸钡溶液产生白色沉淀,推断滤液中存在SO42-,故试管a中充分反应后一定生成了H+、 SO42-。因为得到的SO42-,硫元素化合价升高为氧化产物,发生氧化还原反应则必然要生成其他还原产物,银、硫元素的化合价可能要降低,进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。
(3)若试管a中物质充分反应后不过滤,溶液呈酸性,继续加入1.1 mL Na2S2O3溶液,有刺激性气味产生,根据元素守恒,推断有刺激性气味的气体应该为二氧化硫,则硫元素化合价升高,根据得失电子守恒可知,硫元素化合价降低生成硫单质,离子方程式为![]() 。
。
(4)实验i中加入1.5 mL AgNO3后产生白色沉淀,白色沉淀应为Ag2S2O3,因为过量Ag+与S2O32-结合,使c(S2O32-)降低,Ag2S2O3+3S2O32-![]() 2[Ag(S2O3)2]3-逆向移动,析出沉淀。
2[Ag(S2O3)2]3-逆向移动,析出沉淀。
(5)实验i与实验ii的区别在于硝酸银溶液的滴加方式不同,实验i中逐滴滴加AgNO3时,Ag2S2O3的溶解速率大于分解速率;实验ii根据结论“Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液”,AgNO3溶液与Na2S2O3溶液迅速混合时,部分Ag2S2O3来不及溶解即发生分解,分解产物不能再溶于Na2S2O3。
(6)硫代硫酸银( [ Ag(S2O3)2]3–)用于切花保鲜,[ Ag(S2O3)2]3–中S2O32-与Ag+物质的量之比为2:1,因为Ag2S2O3 +3S2O32- ![]() 2 [ Ag(S2O3)2]3–平衡的存在,为提高[ Ag(S2O3)2]3–产量,Na2S2O3和AgNO3物质的量之比应大于2:1,根据实验i与实验ii的现象对比,为避免反应生成的Ag2S2O3分解,应在不断搅拌下将AgNO3溶液缓缓加入到Na2S2O3溶液中。
2 [ Ag(S2O3)2]3–平衡的存在,为提高[ Ag(S2O3)2]3–产量,Na2S2O3和AgNO3物质的量之比应大于2:1,根据实验i与实验ii的现象对比,为避免反应生成的Ag2S2O3分解,应在不断搅拌下将AgNO3溶液缓缓加入到Na2S2O3溶液中。

 智趣寒假作业云南科技出版社系列答案
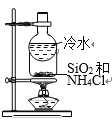
智趣寒假作业云南科技出版社系列答案【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。请回答下列问题:
(1)利用焰色反应可以定性鉴别某些金属盐。灼烧SrSO4时,锶的焰色为_____(填标号)。 A.洋红色 B.浅紫色 C.黄绿色 D.淡蓝色
(2)硫化锶(SrS)可用作发光涂料的原料,SrSO4和碳的混合粉末在隔绝空气下高温焙烧可生成硫化锶和一种还原性气体, 该反应的化学方程式____________________________。
(3)已知:25℃时,K sp(SrSO4)=3.2×10-7,K sp(SrCO3)=1.1×10-10。SrSO4的粉末与Na2CO3溶液混合加热、充分搅拌可生成硫酸钠和碳酸锶,若转化完成时恢复到25℃,混合液中c(CO![]() )=1.0×10-3mol/L,则c(SO
)=1.0×10-3mol/L,则c(SO![]() )=______________________。
)=______________________。
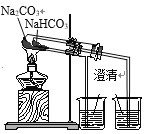
(4)以天青石生产Sr(OH)2·xH2O的工艺如下:

已知: Sr(OH)2 、Ca(OH)2在水中的溶解度如下表:
温度/(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①滤渣2为混有CaCO3的SrCO3,写出反应1生成SrCO3的化学方程式______________。
②固体3 “加热水浸”是为了获得较纯净的Sr(OH)2溶液/span>,此时应缓慢加热使沉淀颗粒长大,滤渣5的主要成分是______(填化学式),“趁热过滤”的目的是_________________________________。
③“操作6”主要有:________________、过滤、洗涤、干燥。
④取m g纯净Sr(OH)2·x H2O产品溶于水,加入过量Na2CO3溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=__________(用含m、n的式子表示)。
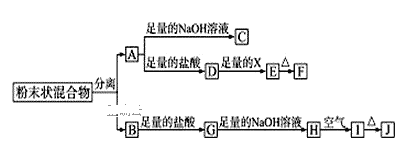
【题目】已知某合金粉末除含铝外,还含有铁、铜中的一种或两种,某兴趣小组在老师的指导下,对合金中铁、铜的存在情况进行了如下探究。
(查阅资料)铁、铜不与氢氧化钠溶液反应。
(猜想)猜想1:该合金粉末中,除含铝外,还含有铁。
猜想2:该合金粉末中,除含铝外,还含有铜。
猜想3:该合金粉末中,除含铝外,还含有_________(填名称)。
(实验探究)下列实验仅供选择的试剂是:10%的盐酸、30%的氢氧化钠溶液。
实验方案 | 实验现象 | 结论 |
①取一定量的合金粉末,加过量的____,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气体放出。 | 合金中一定含有铝。 |
②取步骤①所得滤渣,加过量的______,充分反应。 | 滤渣粉末部分溶解,并有气体放出,溶液呈现浅绿色。 | 合金中一定含有______。 |
(探究结论)猜想3成立。
(反思)一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与氢氧化钠溶液反应的离子方程式__________。
(知识延伸)在一定条件下,铁和铝都能与水反应。写出在相应条件下,铁和水发生反应的化学方程式_______________。