题目内容
6.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解).则电解过程中转移电子的物质的量为( )| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |
分析 碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,所以加入0.1mol碱式碳酸铜[Cu2(OH)2CO3]相当于加入0.2molCuO、0.1molH2O,根据生成物知,阴极上铜离子和氢离子放电、阳极上氢氧根离子放电,根据铜和氢气的物质的量与转移电子之间的关系式计算转移电子的物质的量.
解答 解:碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,所以加入0.1mol碱式碳酸铜[Cu2(OH)2CO3]相当于加入0.2molCuO、0.1molH2O,根据生成物知,阴极上铜离子和氢离子放电、阳极上氢氧根离子放电,根据Cu原子、H原子守恒得阴极上析出n(Cu)=0.2mol、n(H2)=0.1mol,则转移电子的物质的量=0.2mol×2+0.1mol×2=0.6mol,故选C.
点评 本题考查了电解原理,根据离子放电顺序、原子守恒来分析解答,明确加入物质的性质是解本题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量大于生成物总能量 | |
| B. | 若一定条件下,A═B△H<0,说明A物质比B物质稳定 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+ (aq)+OH- (aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |
14.NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L N2和 H2 混合气中含 NA个原子 | |
| B. | 3 mol 单质 Fe 完全转变为 Fe3O4,失去 8NA个电子 | |
| C. | 2 L 0.5 mol•L-1硫酸钾溶液中,含有 NA个阳离子 | |
| D. | 标准状况下,2128 mL 甲醛含有 2.85NA个电子 |
1.向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色(I2被氧化为 HIO3).下列说法正确的是( )
| A. | 整个过程中的还原剂只有I2 | |
| B. | CCl4层由紫色变成无色的化学反应方程式为:I2+5Cl2+6H2O=2HIO3+10HCl | |
| C. | 若用KI和Cl2反应制1molKIO3,至少需要56LCl2(标准状况) | |
| D. | 把 KI换成NBr,则CCl4层变为红棕色.继续滴加氯水,CCl4层的颜色没有变化,则Cl2、HIO3、HBrO3氧化性由弱到强的顺序是:HBrO3<Cl2<HIO3 |
11.关于原电池的叙述中,错误的是( )
| A. | 构成原电池正极和负极的不一定是两种不同的金属 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 在原电池中,电子流出的一极是负极,发生氧化反应 | |
| D. | 原电池放电时,电流的方向是从负极到正极 |
18.下列关于铁的叙述正确的是( )
①铁能被磁铁吸引,但纯铁比含杂质的铁易被腐蚀
②在人体的血红蛋白中含有铁元素
③铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
④铁与强氧化剂硝酸反应的产物只有一种是Fe(NO3)3
⑤不能通过化合反应制得FeCl2和Fe(OH)3.
①铁能被磁铁吸引,但纯铁比含杂质的铁易被腐蚀
②在人体的血红蛋白中含有铁元素
③铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
④铁与强氧化剂硝酸反应的产物只有一种是Fe(NO3)3
⑤不能通过化合反应制得FeCl2和Fe(OH)3.
| A. | ①③ | B. | ②③ | C. | ②⑤ | D. | ④⑤ |
16.2013年6月,我国“蛟龙”号再次刷新“中国深度”--下潜7062米,为我国深海矿物资源的开发奠定了基础.海洋深处有丰富的锰结核矿,锰结核的主要成分是MnO2,同时还含有黄铜矿.
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的.TiO2+发生水解的离子方程式为TiO2++2H2O=H2TiO3↓+2H+.
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示:
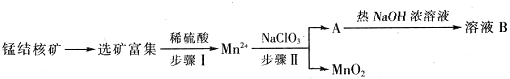
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑.
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是氯酸钠.
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;
(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3
根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是氧化亚铁离子.
(2)设计实验证明炉渣中含有FeO取炉渣少许,用稀硫酸浸取后的溶液使KMnO4溶液褪色.
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
则:①m=33.6g ②写出实验②发生反应后溶液中Fe2+与Fe3+物质的量之比为:3:2.
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的.TiO2+发生水解的离子方程式为TiO2++2H2O=H2TiO3↓+2H+.
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示:
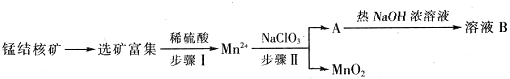
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑.
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是氯酸钠.
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;
(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3
根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是氧化亚铁离子.
(2)设计实验证明炉渣中含有FeO取炉渣少许,用稀硫酸浸取后的溶液使KMnO4溶液褪色.
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
| 实验 | ① | ② | ③ | ④ |
| V(HNO3)/mL | 50 | 100 | 150 | 200 |
| V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
 实验室配制500mL0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL0.5mol•L-1的NaCl溶液,有如下操作步骤: