题目内容
14.NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 标准状况下,22.4 L N2和 H2 混合气中含 NA个原子 | |
| B. | 3 mol 单质 Fe 完全转变为 Fe3O4,失去 8NA个电子 | |
| C. | 2 L 0.5 mol•L-1硫酸钾溶液中,含有 NA个阳离子 | |
| D. | 标准状况下,2128 mL 甲醛含有 2.85NA个电子 |
分析 A、求出混合气体的物质的量,然后根据氮气和氢气均为双原子分子来分析;
B、铁反应生成四氧化三铁后,铁元素变为+$\frac{8}{3}$价,据此分析;
C、求出硫酸钾的物质的量,然后根据1mol硫酸钾中含2mol钾离子、而水也能电离出阳离子来分析;
D、求出甲醛的物质的量,然后根据1mol甲醛中含16mol电子来分析;
解答 解:A、标况下22.4L混合气体的物质的量为1mol,而氮气和氢气均为双原子分子,故1mol混合气体中含2mol原子即2NA个,故A错误;
B、铁反应生成四氧化三铁后,铁元素变为+$\frac{8}{3}$价,故3mol铁失去8mol电子即8NA个,故B正确;
C、溶液中硫酸钾的物质的量n=CV=0.5mol/L×2L=1mol,而1mol硫酸钾中含2mol钾离子,但由于水也能电离出阳离子,故溶液中的阳离子的个数大于2NA个,故C错误;
D、标况下,2128mL甲醛的物质的量n=$\frac{2.128L}{22.4L/mol}$=0.095mol,而1mol甲醛中含16mol电子,故0.095mol甲醛中含1.52mol电子即1.52NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 原子序数之差为2的两种元素不可能位于同一主族 | |
| B. | D-核外有36个电子,则元素D位于第四周期第ⅦA族 | |
| C. | 位于同一主族的甲乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4 | |
| D. | 位于同一周期的甲乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙原子序数可能为x+19 |
9.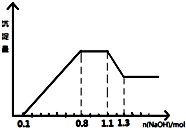 某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
 某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+ | |
| B. | 溶液中一定不含CO32-和NO3-,一定含有SO42- | |
| C. | 溶液中c(NH4+)=0.3 mol/L | |
| D. | c(H+):c(Al3+):c(Mg2+)=1:1:1 |
19.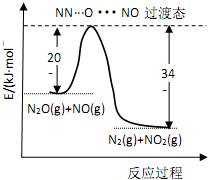 由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
 由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )| A. | 由图分析 N2O(g) 的能量一定高于 NO2(g)+N2(g) | |
| B. | 反应过程中没有发生化学键的断裂和化学键的生成 | |
| C. | 若生成 1mol N2(g),其△H=-139kJ•mol-1 | |
| D. | 由图可知 N2+NO2=N2O+NO△H=+139kJ•mol-1, 若使用催化剂还可以减小反应的热效应 |
6.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解).则电解过程中转移电子的物质的量为( )
| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |
3.某同学实验需要450mL0.1mol•L-1碳酸钠溶液,配制该溶液时下列仪器不需要的是( )
| A. | 100mL量筒、烧杯、玻璃棒 | B. | 托盘天平、500mL容量瓶 | ||
| C. | 酒精灯、三角漏斗、导管 | D. | 胶头滴管、玻璃棒、烧杯 |
4.下列实验操作正确的是( )
| A. | 乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷 | |
| B. | 重结晶法提纯苯甲酸时,为了除去杂质和防止苯甲酸析出,应该趁热过滤 | |
| C. | 配制银氨溶液时,将硝酸银溶液慢慢滴入稀氨水中,产生沉淀后继续滴加到沉淀刚好溶解为止 | |
| D. | 无水乙醇和浓硫酸共热到170℃,将制得的气体通入酸性高锰酸钾可检验制得的气体是否为乙烯 |
