题目内容
16.下列关于反应能量的说法正确的是( )| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量大于生成物总能量 | |
| B. | 若一定条件下,A═B△H<0,说明A物质比B物质稳定 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+ (aq)+OH- (aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |
分析 A.根据放热反应,反应物的总能量要大于生成物的总能量来判断;
B.能量越高越不稳定,结合反应是放热反应分析;
C.燃烧热为1mol的可燃物完全燃烧生成稳定氧化物放出的热量;
D.含0.5 mol H2SO4的浓硫酸溶解过程中伴随热效应.
解答 解:A.△H=-216 kJ•mol-1,表示该反应为放热反应,在放热反应中,反应物的总能量要大于生成物的总能量,故A正确;
B.能量越高越不稳定,A═B△H<0,说明A的能量比B高,所以A不稳定,故B错误;
C.燃烧热为1mol的可燃物完全燃烧生成稳定氧化物放出的热量,2mol氢气放出的热量大于571.6 kJ/mol,故C错误;
D.含0.5 mol H2SO4的浓硫酸溶解过程中伴随热效应,所以放出的热量大于57.3 kJ,故D错误;
故选A.
点评 本题考查了化学反应能量变化的分析判断,理解反应热的概念是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.有些电影、电视剧中的仙境美轮美奂,这些神话仙境中所需的烟雾是NH4NO3和Zn粉按质量比8:6.5混合于温热的石棉网上,使用时滴几滴水后,产生大量白烟,反应式为NH4NO3+Zn═ZnO+N2↑+2H2O,下列说法中正确的是( )
| A. | 该反应中NH4NO3只作氧化剂 | |
| B. | 每还原1mol NO3-,需氧化1mol Zn和1mol NH4+ | |
| C. | 生成的烟中含有ZnO和NH4NO3 | |
| D. | 生成的白烟是N2溶于水形成的小液滴 |
1.关于下列四个图象的说法正确的是( )

| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq) 中的c[Fe(SCN)2+]温度T的平衡图象.A点与B点相比,A点的c(Fe3+) 大 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③表示电源X极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-=O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
6.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解).则电解过程中转移电子的物质的量为( )
| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |

 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
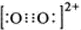 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.